时间:2017-07-27 09:44:12
1、选择题 向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如下图,则原混合溶液中MgCl2与FeCl3的物质的量之比为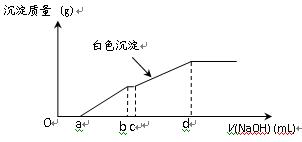
A.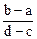
B.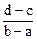
C.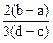
D.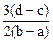
2、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如下图,下列判断错误的是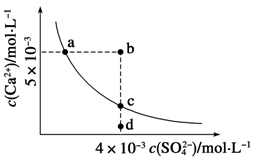
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp不等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO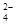 )一定等于3×10-3 mol·L-1
)一定等于3×10-3 mol·L-1
D.向d点溶液中加入适量CaCl2固体可以变到c点
3、选择题 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(2)CuSO4+Na2S: Cu2++S2-=CuS↓
下列几种物质的溶解度大小的比较中,正确的是
A.CuS<Cu(OH)2<CuCO3
B.CuCO3<Cu(OH)2<CuS
C.CuS<CuCO3<Cu(OH)2
D.Cu(OH)2<CuCO3<CuS
4、填空题 有下列七种溶液:A、氢氧化钠溶液;B、氢氧化钡溶液;C、硫酸铝溶液;D、明矾溶液;E、混有少量硝酸的硫酸镁溶液;F、氯化铁溶液;任取其中的一种溶液(甲)逐滴加入到另一种溶液(乙)中至过量,观察到自始至终均有白色沉淀.试回答下列问题:
(1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充)
| 组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 甲 B 乙 D |

5、选择题 已知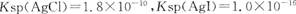 。下列关于不溶物之间转化的说法中正确的是? (? )
。下列关于不溶物之间转化的说法中正确的是? (? )
A.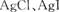 两者都不溶于水,因此AgCl与AgI不能相互转化
两者都不溶于水,因此AgCl与AgI不能相互转化
B.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于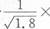
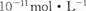
C.一定条件下AgCl可以转化为更难溶的AgI
D.只能由Ksp较大的不溶物转化为Ksp较小的不溶物