时间:2017-07-27 09:34:36
1、选择题 下列叙述中,错误的是
[? ]
A .原子半径:Na >Mg >O
B .13C 和14C 属于同位素
C .0 族元素是同周期中非金属性最强的元素
D .N 和P 属于第ⅤA 族元素,HNO3酸性比H3PO4的强
参考答案:C
本题解析:
本题难度:一般
2、推断题 X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。
请回答下列问题:
(1)X、Y的元素符号依次为_____________、_____________;
(2)XZ2与YZ2分子的立体结构分别是____________和__________,相同条件下两者在水中的溶解度较大的是___________(写分子式),理由是________________;
(3)Q的元素符号是_________,它属于第_________周期,它的核外电子排布式为__________,在形成化合物时它的最高化合价为___________;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键____________。
参考答案:(1)S ;C
(2)V形 ;线形 ;SO2 ;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
(3)Cr ;四 ;1s22s22p63s23p63d54s1?; +6
(4)F-H…F?,?F-H…O?,?O-H…F?,?O-H…
本题解析:
本题难度:一般
3、填空题 用A(质子数)、B(中子数)、C(核外电子数)、?D(最外层电子数)、E(电子层数)填写空格。 ?
(1)原子种类由________决定。 ?
(2)元素种类由________决定。 ?
(3)元素有无同位素由____________决定。 ?
(4)同位素相对原子质量由________决定。 ?
(5)元素的原子半径由____________决定。
参考答案:(1)AB?
(2)A?
(3)B
(4)AB?
(5)AE
本题解析:
本题难度:一般
4、推断题 A、B、C、D、E是原子序数依次增大的短周期元素。A、B处于同一周期,C、D、E处于同一周期。C、B按原子个数比为2:1和1:1分别形成两种离子化合物甲和乙。D、A按原子个数比为3:2形成离子化合物丙。E是地壳中含量最多的金属元素。根据信息回答下列问题:
(1)B元素在周期表中的位置是__________。
(2)化合物乙的电子式____________ ,化合物丙的化学式_____________。
(3)写出E的最高价氧化物对应的水化物分别与A、C两元素的最价氧化物对应的水化物反应的离子方程式_____________ 、______________。
参考答案:(1)第二周期ⅥA族?
(2)“?略”;Mg3N2?
(3)Al(OH)3 + 3H+ = Al3+ + 3H2O;Al(OH)3 + OH- = AlO2- + 2H2O
本题解析:
本题难度:一般
5、推断题 有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径B>C;
②D、E、G是非金属元素,它们都可以跟氢化合生成气态氢化物HD、HE和HG,在室温时,G的单质与氢气暗处混合就爆炸,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体。
(1)A的名称是_________,B位于周期表中第_____周期______族,C的原子结构示意图是________。
(2)E的单质颜色是__________。
(3)A元素与D元素形成化合物的电子式是_____________。
(4)G的单质与水反应的化学方程式是_________________________。
(5)F的元素符号是______________。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是_____________,酸性最强的化学式是___________,气态氢化物最稳定的化学式是_______________。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是________________________________。
参考答案:(1)钠;3;ⅡA
(2)紫黑色
(3)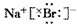
(4)2F2+2H2O==4HF+O2
(5)He
(6)NaOH;HBrO4;HF
(7)Al(OH)3+OH-+2H2O==AlO2-+H2O
本题解析:
本题难度:一般