时间:2017-07-27 09:30:13
1、选择题 下列属于微溶物质的是 ( )
A.AgCl
B.BaCl2
C.CaSO4
D.Ag2S
参考答案:C
本题解析:本题考查的内容属于简单的识记性知识,选项C符合题意。
本题难度:简单
2、选择题 下列液体均处于25℃,有关叙述不正确的是
A.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
B.某物质的溶液中由水电离的c(H+)=1×l0-12mol·L-1,则该物质一定是强碱溶液
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同
D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) < c(CH3COO-)
参考答案:B
本题解析:A.pH=4.5的番茄汁中c(H+)=10-4.5mol/L; pH=6.5的牛奶中c(H+)=10-6.5.前者的c(H+)比后者大102倍,因此c(H+)前者是后者的100倍。正确。B.在室温下,纯水中水电离产生的c(H+)=10-7mol/L.而某物质的溶液中由水电离的c(H+)=1×l0-12mol/L<10-7mol/L,水的大量受到了抑制。可能的外加了酸,也可能是外加了碱。因此该物质可能是酸溶液也可能是碱溶液。错误。C.AgCl在水中存在沉淀溶解平衡:AgCl(s) Cl-(aq)+Ag+(aq)当水中存在Cl-时,AgCl的沉淀溶解平衡受到抑制,溶解度会减小。由于在同浓度的CaCl2和NaCl溶液中Cl-的浓度不同,对沉淀溶解平衡的抑制程度就不同。因此AgCl的溶解度不相同。正确。D. 在溶液中存在电荷守恒即c(Na+)+ c(H+) <c(OH-)+c(CH3COO-)。因为在CH3COOH与CH3COONa混合溶液中,pH=5.6,则溶液显酸性,c(H+)>c(OH-),所以c(Na+) < c(CH3COO-)。正确。
Cl-(aq)+Ag+(aq)当水中存在Cl-时,AgCl的沉淀溶解平衡受到抑制,溶解度会减小。由于在同浓度的CaCl2和NaCl溶液中Cl-的浓度不同,对沉淀溶解平衡的抑制程度就不同。因此AgCl的溶解度不相同。正确。D. 在溶液中存在电荷守恒即c(Na+)+ c(H+) <c(OH-)+c(CH3COO-)。因为在CH3COOH与CH3COONa混合溶液中,pH=5.6,则溶液显酸性,c(H+)>c(OH-),所以c(Na+) < c(CH3COO-)。正确。
本题难度:一般
3、选择题 实验:①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;
③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶
参考答案:B
本题解析:A项,在浊液a中,存在AgCl的沉淀溶解平衡,正确;B项,在滤液b中,仍含有少量Ag+,故在b中生成了AgI沉淀,错误;由于AgI比AgCl更难溶解,向有AgCl存在的c中加入0.1 mol·L-1KI溶液,能发生沉淀转化反应,生成黄色的沉淀AgI,C项和D项都正确。
本题难度:一般
4、选择题 某同学为试验CuS在不同酸中的溶解性,取4份黑色CuS粉末试样置于试管中,分别加入醋酸、浓盐酸、浓硫酸、浓硝酸溶液.观察到如下现象:①CuS不溶于醋酸溶液;②CuS不溶于浓盐酸;③CuS不溶于浓硫酸;④CuS在浓硝酸中溶解,溶液变蓝,并有红棕色刺激性气体产生.根据上述现象,该同学得出了以下结论,其中正确的是( )
A.CuS不溶于弱酸,能溶于强酸
B.CuS不溶于非氧化性酸,能溶于氧化性酸
C.CuS溶于硝酸,是因为硝酸氧化性强于硫酸,S2-被氧化,使溶解沉淀平衡往溶解方向移动
D.CuS溶于硝酸,是因为硝酸的酸性大于硫酸和盐酸的酸性,S2-结合H+,放出H2S气体,使溶解沉淀平衡往溶解方向移动
参考答案:A、CuS不溶于浓硫酸,在浓硝酸中溶解,可以知到硫化铜在强酸浓硫酸中是不溶的,故A错误;
B、浓硫酸、硝酸均是强氧化性的酸,但是硫化铜在强酸浓硫酸中是不溶的,故B错误;
C、CuS溶于硝酸的过程是硫离子被硝酸氧化的过程,S2-被氧化,浓度减小,所以硫化铜的沉淀溶解平衡右移,使得硫化铜溶于硝酸中,故C正确;
D、CuS溶于硝酸的过程是硫离子被硝酸氧化的过程,S2-被氧化,浓度减小,所以硫化铜的沉淀溶解平衡右移,使得硫化铜溶于硝酸中,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
A.在t℃时,AgBr的Ksp为4.9×l0-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)平衡常数K≈816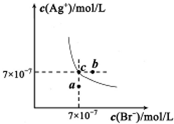
参考答案:A.根据图中c点的c(Ag+)和c(Br-)可得该温度下AgBr的Ksp为4.9×10-13,故A正确;
B.在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,溶解平衡逆向移动,c(Ag+)减小,故B错误;
C.在a点时Qc<Ksp,故a点为AgBr的不饱和溶液,故C正确;
D.K=c(Cl-)c(Br-)=Ksp(AgCl)Ksp(AgBr)=4×10-104.9×10-13≈816,故D正确;
故选B.
本题解析:
本题难度:简单