时间:2017-07-27 09:21:53
1、填空题 (4分)家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出表示丁烷燃烧的热化学方程式:
参考答案:2C4H10(g)+13O2(g)==8CO2(g)+10H2O(l) △H =" -" 5800 kJ/mol
本题解析:略
本题难度:一般
2、选择题 下列说法或表示方法正确的是
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.在10l kPa、25 ℃时,1 g H2完全燃烧生成气态水,放出120.9 kJ的热量,则氢气的燃烧热为241.8 kJ/mol
C.已知:2SO2 (g) + O2 (g)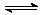 2SO3 (g) ;△H =-98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量
2SO3 (g) ;△H =-98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量
D.由石墨比金刚石稳定可知:C(金刚石,s)= C(石墨,s) ;△H<0
参考答案:D
本题解析:A、反应物的总能量低于生成物的总能量为吸热反应,有可能发生,错误;B、燃烧热为1mol燃料完全燃烧,生成稳定的产物时得反应热,所以生成气态水的反应热不是燃烧热,错误;C、因为SO2与O2的反应为可逆反应,1 mol SO2和0.5 mol O2不可能完全反应,放出的热量要小于49.15kJ;D、石墨比金刚石稳定,说明石墨的能量低于金刚石,所以金刚石转化为石墨为放热反应,△H<0,正确。
本题难度:一般
3、选择题 下列物质既含离子键又含共价键的是
A.CO2
B.NaOH
C.CaCl2
D.C6H6
参考答案:B
本题解析:A、只有共价键,故错;C、只有离子键,故错;D、只有共价键,故错。故选B。
点评:本题考查化学键,明确化学键的类别及成因是解答本题的关键,题目难度不大。
本题难度:简单
4、选择题 已知次氯酸分子的结构式为H—O—Cl,下列有关说法正确的是?(?)
A.依据其结构判断该含氧酸为强酸
B.O原子与H、Cl都形成σ键
C.该分子为极性分子
D.该分子的电子式是H︰O︰Cl
参考答案:BC
本题解析:根据结构式可知氯原子的化合价是+1价,不可能是强酸,A不正确。形成的化学键是单键,所以是σ键,B正确。H-O和O-Cl的强弱不同,所以是极性分子,C正确。由结构式可知电子式为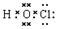 ,D不正确。答案选BC。
,D不正确。答案选BC。
本题难度:一般
5、填空题 (9分)依据叙述,写出下列反应的热化学方程式。
(1)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为____________________________________________________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为____________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为__________________________________________________。
参考答案:(1)N2(g)+2O2(g)===2NO2(g) ΔH=+67.8 kJ·mol-1
(2)C2H2(g)+ O2(g)===2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
O2(g)===2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
(3)N2(g)+3H2(g) 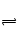
 2NH3(g) ΔH=-92 kJ·mol-1
2NH3(g) ΔH=-92 kJ·mol-1
本题解析:
试题解析:(1)适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收67.8kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=67.8kJ?mol-1;(2)适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收67.8kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=67.8kJ?mol-1;(3)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,所以有10NA个电子转移时,放出1300kJ的热量,则热化学方程式为:C2H2(g)+ O2(g)→2CO2(g)+H2O(l)△H=-1300kJ?mol-1;
O2(g)→2CO2(g)+H2O(l)△H=-1300kJ?mol-1;
(4)在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,所以热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ?mol-1.
考点:热化学方程式
本题难度:一般