时间:2017-07-27 09:10:27
1、选择题 下列说法不正确的是
A.0.1mol/L硫酸铵溶液中各离子的浓度由大到小的顺序是:c (NH4+)>c(SO42-)>c(H+)>c(OH-)
B.在苏打与小苏打的混合溶液中存在:c(Na+)+c(H+) ="c(OH" -)+2c(CO32-)+c(HCO3-)
C.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,证明Na2CO3溶液中存在水解平衡
D.常温常压下能自发进行的反应,一定都是放热反应
参考答案:D
本题解析:硫酸铵化学式为(NH4)2SO4,属于强酸弱碱盐,水溶液呈酸性,所以A正确;根据电荷守恒原理可知,溶液中阴离子带的负电荷总数应该等于阳离子带的正电荷,故B正确;Na2CO3属于强碱弱酸盐,水溶液呈碱性,所以滴有酚酞的溶液变红,当加入氯化钡溶液后,生成碳酸钡沉淀和氯化钠溶液,呈中性,故C正确;能否自发进行,除了和焓变有关,与熵变也有关,它们共同决定,故D错误。
考点:考查电离平衡相关知识
本题难度:一般
2、选择题 下列离子方程式中,属于水解反应的是
A.HCOOH+H2O HCOO-+ H3O+
HCOO-+ H3O+
B.CO2+H2O HCO3-+ H+
HCO3-+ H+
C.CO32-+ H2O HCO3-+ OH-
HCO3-+ OH-
D.HS-+ H2O S2-+ H3O
S2-+ H3O
参考答案:C
本题解析:A.属于电离反应,错误;B.是二氧化碳与水反应后生成碳酸的离子方程式,错误;C.属于水解反应,正确;D.属于电离反应,错误。
考点:考查盐类水解的原理。
本题难度:一般
3、选择题 下列有关说法正确的是
A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
B.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0
C.在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀
D.加热0.1 mol·L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强
参考答案:BD
本题解析:A、虽然合金在潮湿的空气中易形成原电池,但并不是所有合金耐腐蚀性都较差,如不锈钢具有较强的抗腐蚀性,错误;B、MgO(s)+C(s)=Mg(s)+CO(g)为气体物质的量增大的熵增加反应,常温下,该反应不能自发进行,则其△H>0,正确;C、在NaCl和KBr的混合溶液中滴加AgNO3溶液,不一定先产生淡黄色沉淀溴化银,还与氯离子和溴离子浓度有关,错误; D、铝离子水解吸热,加热0.1 mol·L-1Al2(SO4)3溶液,铝离子的水解平衡正向移动,水解程度增大、溶液的酸性增强,正确。
考点:考查金属的腐蚀,化学反应方向,沉淀溶解平衡和盐类的水解。
本题难度:一般
4、填空题 (12分)常温下,ZnS的溶度积常数Ksp=1.20×10-23 ,H2S的电离常数K1=1.32×10-7 K2=7.10×10-15 回答下列问题:
(1)K1>>K2的原因是
(2)0.1 mol/L H2S溶液中氢离子的物质的量浓度是 (填字母)
A.等于0.1mol/L
B.等于0.2mol/L
C.小于0.1mol/L
D.在0.1~0.2mol/L之间
(3)0.1mol/LNa2S 溶液能使pH试纸变蓝,表明该现象的离子方程式是
(4)已知0.1mol/LNaHS溶液的pH约为9,则0.1mol/LNaHS溶液中各离子浓度由大到小的顺序是 。该溶液中的质子守恒关系式为
。
(5)向0.01mol/L的ZnCl2溶液中通入H2S(g)至饱和(c(H2S)按0.1mol/L计),为保证不产生ZnS沉淀,应控制c(H+)不低于 mol/L(已知7.811/2 =2.8)
参考答案:(1)H2S第一步电离出的H+,对HS-的电离起到抑制作用,使HS-更难电离出H+ (2)C (3)S2- +H2O HS-+ OH-
(2)C (3)S2- +H2O HS-+ OH-
(4)c(Na+) > c(HS-) >c(OH-) > c(H+)> c(S2-); c(H2S)+c(H+) =c(OH-)+c(S2-)
(5)0.28
本题解析:(1)根据电离方程式H2S HS-+H+、HS-
HS-+H+、HS- S2-+H+可知,H2S第一步电离出的H+,对HS-的电离起到抑制作用,使HS-更难电离出H+,所以K1远大于K2。
S2-+H+可知,H2S第一步电离出的H+,对HS-的电离起到抑制作用,使HS-更难电离出H+,所以K1远大于K2。
(2)根据H2S的电离平衡常数可知,溶液中氢离子浓度是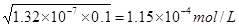 ,所以答案选C。
,所以答案选C。
(3)硫化钠是强碱弱酸盐,S2-水解显碱性。水解方程式为S2- +H2O HS-+ OH-。
HS-+ OH-。
(4)已知0.1mol/LNaHS溶液的pH约为9,说明HS-的水解程度大于HS-的电离程度,所以溶液中各离子浓度由大到小的顺序是c(Na+) > c(HS-) >c(OH-) > c(H+)> c(S2-)。根据电荷守恒c(H+) +c(Na+) ==c(HS-)+c(OH-)+2c(S2-)和物流守恒c(Na+) ==c(HS-)+c(OH-)+c(H2S)可知,质子守恒是c(H2S)+c(H+)=c(OH-)+c(S2-)。
(5)溶液中锌离子浓度是0.01mol/L,所以根据溶度积常数表达式可知,硫离子浓度是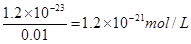 。根据电离平衡常数表达式可知
。根据电离平衡常数表达式可知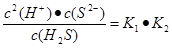 ,所以此时溶液中氢离子浓度是
,所以此时溶液中氢离子浓度是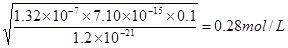 ,即溶液中氢离子不能低于0.28mol/L。
,即溶液中氢离子不能低于0.28mol/L。
本题难度:困难
5、选择题 物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
A.HX、HY、HZ
B.HZ、HY、HX
C.HX、HZ、HY
D.HY、HZ、HX
参考答案:A
本题解析:根据酸根离子水解程度越大,其盐溶液碱性越强,对应的酸越弱来判断。由于pH越大,其盐溶液碱性越强,说明酸根离子水解程度越大,对应的酸越弱,所以HX、HY、HZ的酸性由强到弱的顺序为HX>HY>HZ,答案选A。
考点:考查盐类水解的应用
本题难度:一般