时间:2017-07-27 08:59:10
1、选择题 已知常温下:Ksp(AgCl) =1.8×10 -10,Ksp(Ag2CrO4)=1.9×10-12。则下列叙述正确的是
[? ]
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小
B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp( AgBr)
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1 KCl和0.001 mol·L-1 K2CrO4的混合溶液中,先产生
Ag2CrO4 沉淀
D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
参考答案:D
本题解析:
本题难度:一般
2、选择题 把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2++2OH-
Ca2++2OH-
当向悬浊液中加入少量生石灰后,若温度保持不变,下列说法正确的是(?)?
A.溶液中Ca2+数目增多
B.溶液中Ca2+数目不变
C.c(Ca2+)增大
D.c(Ca2+)不变
参考答案:D
本题解析:把Ca(OH)2放入蒸馏水中,达到沉淀溶解平衡后,溶液即是饱和溶液,再加入生石灰,反应消耗水,则原溶液会析出一部分氢氧化钙固体,Ca2+数目减少,但溶液还是饱和溶液,各微粒的浓度不变。故选D
本题难度:一般
3、填空题 活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):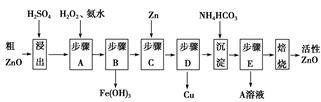
已知:几种离子生成氢氧化物沉淀时的pH如表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
参考答案:(1)2Fe2++H2O2+2H+=2Fe3++2H2O 3.2~5.2 (2)(NH4)2SO4 (3)> (4)0.78
本题解析:(1)步骤A加入H2O2的目的是将Fe2+氧化为Fe3+便于除去,同时不引入新的杂质。由流程图看出该步操作只生成Fe(OH)3沉淀,结合表中数据可知需控制溶液pH为3.2~5.2之间。
(2)硫酸锌溶液中加入碳酸氢铵后生成碱式碳酸锌沉淀和硫酸铵。
(3)反应自发,且ΔH>0,则ΔS必大于0。
(4)由c(Zn2+)×c2(OH-)=Ksp
c(Zn2+)=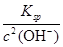 =
=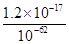 =1.2×10-5(mol·L-1),即1.2×10-5 mol·L-1×65 g·mol-1=7.8×10-4g·L-1,即0.78 mg·L-1
=1.2×10-5(mol·L-1),即1.2×10-5 mol·L-1×65 g·mol-1=7.8×10-4g·L-1,即0.78 mg·L-1
本题难度:困难
4、填空题 与c(H+)·c(OH-)=KW类似,FeS饱和溶液中 c( Fe2+ )·c(S2- )=Ksp。常温下Ksp=8.1×10-17 。
(1)理论上FeS的溶解度为____g,而事实上其溶解度远 大于这个数值。其原因可能是___。
(2)已知H2S饱和溶液中c(H+)与C(S2- )之间存在以下限 量关系:[c(H+)]2·c(S2-) =1.0×10-22,为了使溶液里 c( Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中。应 调节溶液中的c(H+)为____ mol/L。
参考答案:(1)7.92×10-8? ;在FeS的饱和溶液中存在FeS(s) 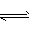 Fe2+ (aq) +S2- (aq),生成的S2-、Fe2+发生水解:
Fe2+ (aq) +S2- (aq),生成的S2-、Fe2+发生水解:
S2- +H2O 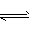 HS- +OH- ,Fe2+ +2H2O
HS- +OH- ,Fe2+ +2H2O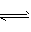 Fe(OH)2 +2H+.致使c( Fe2+)与 c(S2-)降低,
Fe(OH)2 +2H+.致使c( Fe2+)与 c(S2-)降低,
促使FeS(s)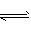 Fe2+ (aq)+S2-( aq)的溶解平衡向溶解方向进行
Fe2+ (aq)+S2-( aq)的溶解平衡向溶解方向进行
(2)1.11×10-3
本题解析:
本题难度:一般
5、选择题 已知:Ksp(Ag2SO4)=1.4×10-5 mol3.L-3 ,Ksp(Ag2CO3)=8.1×10-12 mol3.L-3,
K sp( AgCl)=1.8×10-10 mol2.L-2 ,Ksp (AgI)=8.3×10-17 mol2.L-2,在下列各饱和溶液中,c(Ag+)由大到小的顺序是
[? ]
A. Ag2SO4>AgCl>Ag2CO3 >AgI
B. Ag2SO4 >Ag2CO3 >AgCl>AgI
C. Ag2SO4 >AgCl>AgI>Ag2CO3
D. Ag2SO4>Ag2CO3 >AgI>AgCl
参考答案:A
本题解析:
本题难度:一般