时间:2017-07-27 08:55:09
1、选择题 下列叙述中与盐类的水解有关的是( )
①明矾和FeCl3可作净水剂,②为保存FeCl3溶液,要在溶液中加少量盐酸,③实验室配制AlCl3溶液时,应先把它溶在较浓的盐酸中,然后加水稀释,④NH4Cl与ZnCl2溶液可作焊接中的除锈剂,⑤实验室盛放Na2CO3溶液的试剂瓶应用橡皮塞,而不用玻璃塞,⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂,⑦长期使用硫酸铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用
A.①④⑦
B.②⑤⑦
C.③⑥⑦
D.全有关
参考答案:D
本题解析:①明矾和氯化铁水解生成氢氧化铝胶体、氢氧化铁胶体,因此可以做净水剂;②在氯化铁溶液中加入盐酸,抑制水解;④氯化铵、氯化锌溶液水解呈酸性,利用酸溶解金属氧化物;⑤碳酸钠水解,溶液呈碱性,与二氧化硅反应生成具有黏合性的硅酸钠;⑥碳酸氢钠和硫酸铝溶液混合,发生双水解;⑦硫酸铵水解,溶液呈酸性,铵态氮肥水解呈酸性,而草木灰的主要成分是碳酸钾,水解呈碱性,所以答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,主要是考查学生对盐类水解知识的了解程度,有利于调动 91exam .org学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和灵活应变能力。该题的关键是明确盐类水解的含义、特点,然后结合题意灵活运用即可
本题难度:简单
2、选择题 下列叙述正确的是
A.将一定体积醋酸溶液加水至原来体积的m倍,则pH增大m
B.250C, pH=13的Ba(OH)2溶液和pH=1的盐酸中均存在:
C 250C, pH=8的NaOH溶液和pH=8的氨水中,由水电离出的c (0H_)不相等
D.在NaHCO3溶液中: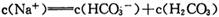
参考答案:B
本题解析:本题考查水溶液的离子平衡的有关知识。醋酸是弱酸,在加水稀释过程中,继续电离,产生更多的氢离子,则pH增大小于lgm倍,A错;水的离子常数只与温度有关,与溶液中的氢离子或氢氧根离子浓度大小无关,温度不变,水的离子积就不变,250C时为 ,B正确;在水中加碱抑制水的电离,pH=8的NaOH溶液和pH=8的氨水中,OH-浓度相等,抑制程度相同,故由水电离出的c (0H_)相等,C错;在NaHCO3溶液中,HCO3-进入溶液后,将以三种形式存在,即HCO3-、CO32-、H2CO3,则溶液中的物料守恒表达式应为c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3),故D错。
,B正确;在水中加碱抑制水的电离,pH=8的NaOH溶液和pH=8的氨水中,OH-浓度相等,抑制程度相同,故由水电离出的c (0H_)相等,C错;在NaHCO3溶液中,HCO3-进入溶液后,将以三种形式存在,即HCO3-、CO32-、H2CO3,则溶液中的物料守恒表达式应为c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3),故D错。
本题难度:一般
3、选择题 为了使FeCl3溶液中c(Fe3+)/c(Cl-)增大,可加入的物质是( )
A.适量的HCl气体
B.适量的醋酸钠固体
C.适量的稀HNO3
D.适量的NaOH固体
参考答案:在氯化铁溶液中,存在铁离子的水解,水解方程式为:Fe3++3H2O?Fe(OH)3+3H+;
A、加入适量的HCl,会使水解平衡向左移动,铁离子浓度增大,但是氯离子浓度也增大,比值不一定增大,故A错误;
B、加入适量的醋酸钠固体,会使水解平衡右移,铁离子浓度减小,比值减小,故B错误;
C、加入适量的稀HNO3后,水解平衡左移,铁离子浓度增大,氯离子浓度几乎不变,所以比值是增大的,故C正确;
D、加入适量的NaOH固体,会使水解平衡右移,铁离子浓度减小,比值减小,故D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 常温下,0.1 mol·L-1的HA溶液中c(OH-)/c(H+)=1×10-8,下列叙述中正确的是
A.0.01mol·L-1 HA的溶液中c(H+)=1×10-4 mol·L-1
B.pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中c(Na+)>c(A-)>c(OH-)>c(H+)
C.pH=3的HA溶液与pH=11的NaO H溶液按体积比l:10混合后所得溶液中c(OH-)+c(A-)=c(H+)+c(Na+)
D.浓度均为0.1 mol·L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(OH-)-c(H+)<c(HA)-c(A-)
参考答案:C
本题解析:根据题意知,常温下,0.1 mol·L-1的HA溶液中c(OH-)/c(H+)=1×10-8,而Kw=c(H+)c(OH-)=10-14,则溶液中氢离子浓度为0.001mol·L-1,则HA为弱酸; A、HA为弱酸,加水稀释,促进电离,0.01mol·L-1 HA的溶液中c(H+)>1×10-4 mol·L-1,错误;B、HA为弱酸,pH=3的HA溶液与pH=11的NaOH溶液等体积混合后HA远远过量,所得溶液中c(A-)>c(Na+)>c(H+)>c(OH-),错误;C、根据电荷守恒判断,pH=3的HA溶液与pH=11的NaO H溶液按体积比l:10混合后所得溶液中c(OH-)+c(A-)=c(H+)+c(Na+),正确;D、浓度均为0.1 mol·L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则HA的电离程度大于NaA,则c(H+)- c(OH-)-<c(A-)-c(HA),错误。
本题难度:一般
5、选择题 一元酸HA,一元强碱MOH,两者以等浓度等体积混合,下列说法一定正确的是()
A.c(A-)≤c(M+)
B.c(A-)≥c(M+)
C.若MA不水解,则c(OH-)<c(H+)
D.若MA水解,则c(OH-)≥c(H+)
参考答案:A
本题解析:HA可能是强酸,也可能是弱酸。
本题难度:简单