时间:2017-07-27 08:46:08
1、填空题 (7分)
(1)在25℃条件下将pH=3的醋酸稀释100倍后溶液的pH为?
A.5
B.1
C.1~3之间
D.3~5之间
(2)常温下,pH=3的盐酸和pH=11的氨水等体积混合后,混合溶液中
c(Cl-)?c(NH4+)(填“>”、“=”或“<”)。
(3)常温下,已知某CH3COONa溶液中的c(Na+)=c(CH3COO一),则该溶液的pH?7(填“>”、“=”或“<”)。
(4)如果将NaOH和NH4Cl溶液等浓度、等体积混合,则混合溶液中各离子浓度由大到小的顺序为:c(? )?c(? )?c(? )?c(? )?c(? )
[括号内填离子符号,“?”上填写“>”或“=”]
(5)常温下等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:_____________________________(填序号)
参考答案:(共7分)? (1)D(1分)? (2)< (1分)? (3)= (1分)?
(4)c(Na+)=c(Cl--)>c(OH--)>c(NH4+)>c(H+)(2分)? (5)①②③④(2分)
本题解析:(1)醋酸为弱酸,稀释会不断电离出氢离子,所以,pH=3的醋酸稀释100倍后溶液的pH为3~5之间;
(2)pH=3的盐酸和pH=11的氨水等体积混合后,因氨水为弱电解质,氨水过量,所以混合后溶液中的溶质为NH4CL、NH3·H2O;所以,混合溶液中c(Cl-)<c(NH4+);
(3)由电荷守恒可得c(Na+)+c(H+)=c(CH3COO一)+c(OH—);当c(Na+)=c(CH3COO一)时,溶液中c(H+)= c(OH—);即得该溶液的pH=7;
(4)因NH4+要发生水解,所以,c(Na+)=c(Cl--)>c(OH--)>c(NH4+)>c(H+);
(5)①由于AL3+水解溶液显酸性,会抑制NH4+的水解;③由于CH3COO—水解溶液显碱性,会促进NH4+的水解;所以,c(NH4+) 由大到小的顺序是:①②③④
本题难度:一般
2、填空题 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答。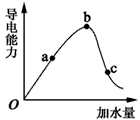
(1)O点为什么不导电______________________________________。
(2)a、b、c三点的pH由小到大的顺序为 ___________________ 。
(3)a、b、c三点中,醋酸的电离程度最大的一点是_____________ 。
(4)若要使c点溶液中的c(CH3COO-)增大,在如下措施中,不可行的是_________________。
A.加热 B.加水 C.加固体KOH D.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的是__________。
A.c(H+) B.H+个数 C.CH3COOH分子数
参考答案:(1)因为冰醋酸未电离,无自由移动的离子
(2)b<a<c
(3)c
(4)B
(5)B
本题解析:
本题难度:一般
3、选择题 (j她11?门头沟区模拟)下列叙述中的前后两九量之比为1:j的是( )
A.液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛液体的体积
B.相同温度下,0.1mol/L乙酸溶液与0.2mol/L乙酸溶液中,c(H+)之比
C.氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(S
参考答案:A.碱式滴定管下端没有刻度的地方有溶液,则液面在“5”刻度时,25mL碱式滴定管和55mL碱式滴定管所盛液体的体积不是1:2,故A错误;
B.弱酸的浓度越小,电离程度越大,则相同温度下,5.1mol/L乙酸溶液与5.2mol/L乙酸溶液中,c(H+)之比大于1:2,故B错误;
C.pH=7时c(H+)=c(OH-),由电荷守恒可知c(H+)+c(NH4+)=c(OH-)+c(SO42-),则c(NH4+)=c(SO42-),故C错误;
0.强碱完全电离,pH=12 的溶液中c(OH-)=5.51mol/L,c〔(Ba(OH)2〕=5.555mol/L,c(KOH)=5.51mol/L,所以c〔(Ba(OH)2〕:c(KOH)=1:2,故0正确;
故选0.
本题解析:
本题难度:一般
4、填空题 在稀氨水中存在下述电离平衡NH3+H2O NH3 ·H2O
NH3 ·H2O NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | ? | ? | ? |
| 平衡移动方向 | ? | ? | ? |
参考答案:
逆向
正向
逆向
减小
减小
增大
本题解析:氨水中存在NH3+H2O NH3?H2O
NH3?H2O NH4++OH-,向氨水中加入少量硫酸铵,硫酸铵电离出铵根离子,导致溶液中铵根离子浓度增大,抑制氨水电离,平衡向左移动,所以溶液中氢氧根离子浓度减小;向氨水中加入少量硝酸,氢离子和氢氧根离子反应,导致氢氧根离子浓度减小,促进氨水电离,平衡向右移动;向氨水中加入少量氢氧化钾,导致氢氧根离子浓度增大,抑制氨水电离,平衡向左移动,故答案为:
NH4++OH-,向氨水中加入少量硫酸铵,硫酸铵电离出铵根离子,导致溶液中铵根离子浓度增大,抑制氨水电离,平衡向左移动,所以溶液中氢氧根离子浓度减小;向氨水中加入少量硝酸,氢离子和氢氧根离子反应,导致氢氧根离子浓度减小,促进氨水电离,平衡向右移动;向氨水中加入少量氢氧化钾,导致氢氧根离子浓度增大,抑制氨水电离,平衡向左移动,故答案为:
加入的物质
少量(NH4)2SO4固体
少量HNO3溶液
少量KOH溶液
c(OH-)的变化
减小
减小
增大
平衡移动方向
逆向
正向
逆向
本题难度:一般
5、选择题 下列关于强、弱电解质的叙述中正确的是( )
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C.强电解质熔化时都完全电离,弱电解质在水溶液中部分电离
D.强电解质不一定能导电,弱电解质溶液的导电能力不一定比强电解质弱
参考答案:D
本题解析:强极性的共价化合物也是强电解质,A错误;强、弱电解质与溶解性无关,B错误;溶于水或熔化时完全电离的电解质是强电解质,C错误;电解质导电是有条件的,溶液的导电性与溶液中离子所带的电荷浓度有关,D正确。
本题难度:一般