时间:2017-07-27 08:42:52
1、选择题 下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为285.8 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) ΔH1; 2C(s)+O2(g)==="2CO(g)" ΔH2,则ΔH1>ΔH2
参考答案:A
本题解析:A、燃烧热是指完全燃烧1mol氢气生成最稳定的氧化物液态水过程所放出的热量,根据反应2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol,则氢气的燃烧热为-285.8kJ/mol,A正确;B、根据60C(石墨,s)=C60(s);△H>0,可以知道C60比石墨的能量高,所以C60不如石墨稳定,B错误;C、中和热是稀的强酸和强碱反应生成1mol水所放出的热量,20.0g即0.5molNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4kJ/mol,C错误;D、碳的燃烧反应是放热反应,完全燃烧放出的热多于不完全燃烧放出的热,但是焓变是负数,所以△H1<△H2,D错误;答案选A。
考点:考查热化学方程式。
本题难度:一般
2、简答题 有下列几种物质:①Ne、②NH4Cl、③NaOH、④Cl2、⑤H2O、⑥Na2O2.
(1)上述物质中,属于共价化合物的是______(填序号,下同),既存在离子键又存在非极性键的是______
(2)②号物质的电子式为______、用电子式表示⑤号物质的形成过程:______.
参考答案:(1)因一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间形成共价键.所以②、③、⑤含有极性键,②、③中含有离子键和极性键,④中含有非极性键,⑥中含有离子键和非极性键,①中无化学键,含有离子键的化合物就是离子化合物,全部由共价键形成的化合物是共价化合物,所以⑤是共价化合物,既存在离子键又存在非极性键的是⑥,
故答案为:⑤;⑥;
(2)NH4Cl是离子化合物,由铵根离子和氯离子构成,其电子式为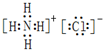 ;
;
H2O是由2个H原子和1个O原子通过形成共用电子对形成的,形成过程为: ,
,
故答案为: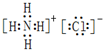 ;
; .
.
本题解析:
本题难度:一般
3、选择题 下列物质中,既有离子键又有共价键的是
A.CaCl2
B.KOH
C.H2O
D.HF
参考答案:B
本题解析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,如果是同一种非金属原子之间形成共价键,则是非极性键。不同种非金属原子之间形成的是极性键。据此可知选项A中只有离子键,B中既有离子键,还有极性键,C、D中只有极性键,答案选B。
点评:该题是高考中的常见考点,属于基础性试题的考查,试题基础性强,侧重对学生基础知识的训练,主要是考查学生灵活运用化学键知识解决实际问题的能力。该题的关键是明确离子键、共价键的含义和判断依据,然后结合题意灵活运用即可。
本题难度:一般
4、选择题 固体冰中不存在的作用力是( )
A.离子键
B.极性键
C.氢键
D.范德华力
参考答案:A、固体冰为分子晶体,不含有离子,不存在离子键,故A符合;
B、分子中O-H键为极性键,故B不符合;
C、分子间氧原子和氢原子之间形成氢键,故C不符合;
D、水分子之间存在范德华力,故D不符合;
故选A.
本题解析:
本题难度:简单
5、选择题 已知1 mol白磷变成1 mol红磷放出18.39KJ热。下列两个反应:4P(白、固)+5O2(气)=2P2O5(固)+Q1,4P(红、固)+5O2(气)=2P2O5(固)+Q2,其中Q1与Q2的关系正确的是?
A.Q1=Q2
B.Q1>Q2
C.Q1<Q2
D.无法比较
参考答案:B
本题解析:由题意可知4P (白、固)=4P(红、固)+Q,则Q1=Q2+Q,因此,答案选B。
本题难度:一般