时间:2017-07-27 08:30:13
1、选择题 下列结论正确的是
[? ]
①微粒半径:S2->Cl>S>F ②氢化物稳定性:HF>HCl>H2S>H2Se ③离子还原性:S2->Cl->Br->I-
④单质氧化性:Cl2>S>Se>Te ⑤酸性:H2SO4>HClO4>H2SeO4
⑥分散系中分散质粒子的直径:Fe(OH)3悬浊液> Fe(OH)3胶体>FeCl3溶液
A.只有①
B.只有⑥
C.②④⑥
D.①③④
2、填空题 19世纪中叶,门捷列夫总结出了如下表所示的元素化学性质的变化规律。请回答 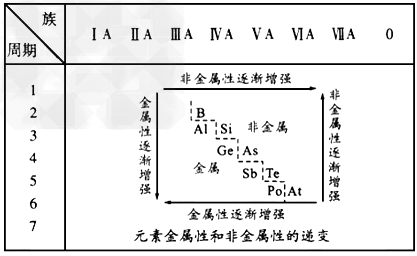
(1)门捷列夫的突出贡献是_______。 ?
A.提出了原子学说?B.提出分子学说 ?C.发现元素周期律?D.发现能量守恒定律
(2)该表变化表明_______。 ?
A.物质的性质总是在不断变化的 ?
B.元素周期表中最右上角的氦元素是非金属性最强的元素 ?
C.第IA族元素的金属性肯定比同周期的第ⅡA族元素的金属性强 ?
D.物质发生量变到一定程度必然引起质变 ?
(3)按照表中元素的位置,认真观察从第ⅢA族的硼到第ⅦA族的砹连接的一条折线,我们能从分界线附近找到_______。 ?
A.耐高温材料?B.新型农药材料 ?C.半导体材料?D.新型催化剂材料 ?
(4)据报道,美国科学家制得一种新原子283116X,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是_______。 ?
A.这种原子的中子数为167 ?B.它位予元素周期表中第六周期 ?
C.这种元素一定是金属元素 ?D.这种元素的原子易与氢化合
3、推断题 已知:①A、B、C、D四种物质均含有元素X,可能还含有元素Y或Z。元素Y、X、Z的原子序数依次递增且不超过20。② X在A、B、C、D中的化合价分别为0、-1、+1、+5。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D在二氧化锰催化下受热分解,可制得元素Y的单质。
请回答下列问题:
(1)写出元素X、Y、Z的元素符号:X:_______,Y:_______,Z:_______。
(2)写出A、B、C、D的化学式:A_______,B_______,C_______,D_______。
(3)画出Y原子的结构示意图_______;写出③中反应的化学方程式_____________________。
(4)写出④中反应的化学方程式_____________________。实验室通过反应④制得元素Y的单质后,如何将产物分离并分别获得纯净物?写出实验步骤:__________________________________________
(5)制得元素Y的单质,若收集到标准状况下6.72LY单质气体,至少需要多少克化合物D?同时生成氯化物的物质的量为多少mol?(用涉及到的化学式写出计算步骤)
4、选择题 下列表达方式错误的是( )
A.H﹕Cl
B.
C.818O
D.O=C=O
5、选择题 下列是几种粒子的结构示意图,有关说法不正确的是 
[? ]
A.①和②属同种元素
B.②属于稀有气体元素
C.①和③的化学性质相似
D.④属于金属元素