时间:2017-07-27 08:27:39
1、实验题 (11分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: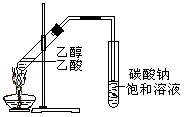
(1)写出制取乙酸乙酯的化学反应方程式,并指出其反应类型:_____ _________ ,属于_______________反应。
(2)浓硫酸的作用是:①_________________________;②____________________。
(3)装置中通蒸气的导管要插在_____________溶液的液面上,不能插入溶液中,目的是防止_______ 。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是___________。
A.蒸馏? B.分液? C.过滤? D.结晶
(5)用30克乙酸与46克乙醇反应,如果实际产率是理论产率的67%,则可得到乙酸乙酯的质量是______________。
A.29.5克? B.44克? C.74.8克? D.88克
2、选择题 硫酸厂有一辆已存放过浓硫酸的铁槽车。某工人违反规程,边吸烟边用水冲洗,结果发生了爆炸事故。下列引起爆炸的原因中正确的是
[? ]
A.浓硫酸遇明火爆炸
B.浓硫酸遇水放热爆炸
C.铁与水(常温下)产生的氧化物爆炸
D.稀释后的硫酸与铁反应产生的氢气接触空气并遇明火而爆炸
3、填空题 (三选一)【化学与技术】
硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在_________(填编号)的郊区。
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t98%的硫酸需消耗3.6×10kJ能量。请通过计算判断,若反应:SO2(g)+O2(g)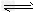 SO3(g) △H=-98.3kJ/mol放出的热量能在生产过程中得到充分利用,则每生产1t98%的硫酸只需外界提供(或可向外界输出)____kJ能量。
SO3(g) △H=-98.3kJ/mol放出的热量能在生产过程中得到充分利用,则每生产1t98%的硫酸只需外界提供(或可向外界输出)____kJ能量。
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为___________________。
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4 (由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)。 
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因是_____________________
4、选择题 以下用于除去乙酸乙酯中乙酸和乙醇杂质的最好试剂是( )。
A.饱和碳酸钠溶液
B.氢氧化钠溶液
C.苯
D.水
5、选择题 下图是一种稀酸对Fe-Gr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是 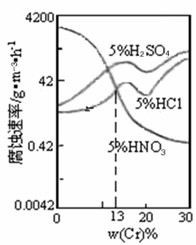
[? ]
A. 稀硫酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B. 稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)→Fe(NO3)3+3NO2↑+3H2O
C. Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强
D. 随着Cr含量增加,稀硫酸对Fe-Cr合金的腐蚀性减弱