时间:2017-07-27 08:08:05
1、选择题 实验室中保存少量金属钠的方法是
A.放在水中
B.放在四氯化碳中
C.放在煤油中
D.放在细沙中
参考答案:C
本题解析:分析:钠的保存方法选择需要考虑钠的物理、化学性质,例如钠与空气和水发生反应,与四氯化碳、汽油、煤油不反应,钠的密度比四氯化碳小、比煤油、汽油的密度大.
解答:A、金属钠和水之间能反应,所以不能保存在水中,故A错误;
B、金属钠与四氯化碳不反应,但密度比四氯化碳小,浮于四氯化碳的上面,能接触到空气,所以钠不能保存四氯化碳中,故B错误;
C、金属钠与煤油不反应,且密度比煤油大,沉于煤油底部,隔开了空气,所以钠能保存在煤油中,故C正确;
D、细沙中有氧气,钠能和氧气发生生成氧化钠而变质,所以钠不能保存在细沙中,故D错误;
故选C.
点评:本题以钠的储存方法的选择为载体考查了钠的物理、化学性质,难度不大,可以根据金属的性质选择相应的储存方法.
本题难度:简单
2、选择题 下列气体中所含分子数目最多的是
A.1gH2
B.10gO2
C.30gCl2
D.17gNH3
参考答案:D
本题解析:分析:根据n= 计算各物质的物质的量,根据N=nNA可知,物质的量越大,所含的分子数越多,据此判断.
计算各物质的物质的量,根据N=nNA可知,物质的量越大,所含的分子数越多,据此判断.
解答:A、1gH2的物质的量为 =0.5mol,
=0.5mol,
B、10gO2的物质的量为 =
= mol,
mol,
C、30gCl2的物质的量为 =
= mol,
mol,
D、17gNH3的物质的量为 =1mol,
=1mol,
所以物质的量由大到小的顺序为D>A>C>B.
故选D.
点评:本题考查常用化学计量数的有关计算,难度较小,关键在于清楚物质的量越大,所含的分子数越多,注意公式运用.
本题难度:一般
3、选择题 某学生要配置100ml.0.5mol.L-1NaCl溶液,不需要的仪器是
A.250ml容量瓶
B.胶头滴管
C.烧杯
D.玻璃棒
参考答案:A
本题解析:分析:配制100ml.0.5mol.L-1NaCl溶液需要的仪器有100mL容量瓶、玻璃棒、胶头滴管、烧杯、若用固体配制还需要托盘天平等.
解答:配制100ml.0.5mol.L-1NaCl溶液需要的仪器有100mL容量瓶、玻璃棒、胶头滴管、烧杯、若用固体配制还需要托盘天平,故不需要250mL容量瓶,故选A.
点评:考查一定物质的量浓度溶液的配制,比较基础,注意掌握溶液配制的操作.
本题难度:困难
4、选择题 下列变化中,属于物理变化的是
A.氧气溶于水
B.一氧化碳燃烧
C.钠溶于水
D.氢气燃烧
参考答案:A
本题解析:分析:本题考查学生对物理变化和化学变化的确定.判断一个变化是物理变化还是化学变化,要依据在原子核不变的情况下,变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化.
解答:A、氧气溶于水,没有新物质生成,属于物理变化,故A正确;
B、一氧化碳燃烧有新物质生成,属于化学变化,故B错误;
C、钠溶于水与水反应有新物质氢氧化钠和氢气生成,属于化学变化,故C错误;
D、氢气燃烧有新的物质水生成,属于化学变化,故D错误.
故选A.
点评:搞清楚物理变化和化学变化的本质区别是解答本类习题的关键.判断的标准是看在变化中有没有生成其他物质.一般地,物理变化有物质的固、液、气三态变化和物质形状的变化.
本题难度:一般
5、选择题 NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.1mol/L的100mL?FeCl3溶液中,含有的离子数为0.04NA
B.标准状况下,将m1克锌加入到m2克20%的盐酸中放出nLH2,则转移电子数为nNA/11.2
C.9gD2O中含有的电子数为5NA
D.120g由NaHSO4和KHSO3组成的混合物中共含有3NA的阴阳离子
参考答案:B
本题解析:分析:A、铁离子水解生成氢氧化铁和氢离子,溶液中离子数增多;
B、锌和氯化氢的量不能确定,依据化学反应生成氢气计算电子转移;
C、依据n= ,结合分子式计算电子数;
,结合分子式计算电子数;
D、NaHSO4和KHSO3的摩尔质量相同,120g混合物依据n= ,计算得到物质的量,硫酸氢钠是钠离子和硫酸氢根离子构成,亚硫酸氢钾是钾离子和亚硫酸氢根离子构成;
,计算得到物质的量,硫酸氢钠是钠离子和硫酸氢根离子构成,亚硫酸氢钾是钾离子和亚硫酸氢根离子构成;
解答:A、0.1mol/L的100mL FeCl3溶液中,Fe3++3H2O?Fe(OH)3+3H+,含有的离子数大于0.04NA,故A错误;
B、标准状况下,将m1克锌加入到m2克20%的盐酸中放出nLH2,锌和氯化氢的量不能确定,依据化学反应生成氢气计算,2H+~H2~2e-,转移电子数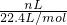 ×2×NA=
×2×NA= ,故B正确;
,故B正确;
C、9gD2O物质的量= =
=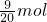 ,分子中含有的电子数=
,分子中含有的电子数=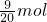 ×10×NA=4.5NA ,故C错误;
×10×NA=4.5NA ,故C错误;
D、NaHSO4和KHSO3的摩尔质量相同为120g/mol,120g由NaHSO4和KHSO3物质的量为1mol,硫酸氢钠是钠离子和硫酸氢根离子构成,亚硫酸氢钾是钾离子和亚硫酸氢根离子构成;,组成的混合物中共含有2NA的阴阳离子,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要考查盐类水解生成两种数的特征,气体摩尔体积的条件应用,氧化还原反应电子转移,混合物的组成特征分析,题目难度中等.
本题难度:一般