时间:2017-07-18 02:56:31
1、填空题
(10分)(1)AgNO3的水溶液呈?(填“酸”、“中”、“碱”)性,常温时的pH ?7(填“>”、“=”、“<”),原因是(用离子方程式表示):?;?实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以?(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈?性,原因是(用离子方程式表示):?________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是??。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的??。
2、填空题 (1)向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为?。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到白色沉淀转变为红褐色沉淀。简述产生该现象的原因:?。
(3)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字): c(OH-)-c(HA)=??mol/L。
(4)已知25℃时,AgCl的溶解度为1.435×10-4g,则该温度下AgCl的溶度积常数
Ksp= ??mol2/L2。
电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
3、选择题 在0.1 mol·L-1Na2CO3溶液中,各种微粒之间存在下列关系,其中不正确的是(?)
A.c(Na+)+c(H+)=2c(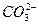 )+c(
)+c(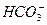 )+c(OH-)
)+c(OH-)
B.c(Na+)=2[c(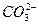 )+c(
)+c(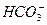 )+c(H2CO3)]
)+c(H2CO3)]
C.c(OH-)=c(H+)+c(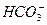 )+2c(H2CO3)
)+2c(H2CO3)
D.c(Na+)=c(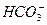 )=c(OH-)=c(H+)
)=c(OH-)=c(H+)
4、填空题 在一定条件下Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
A.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
B.升高温度,溶液的PH值减小
C.稀释溶液,溶液中c(H+)和c(OH-)都减少
D.加入NaOH固体,溶液pH减小
5、选择题 在醋酸与氢氧化钠溶液的反应过程中,溶液中的相关离子浓度呈现出下列排列顺序: c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。满足该条件的反应是
A.0.01mol·L-1的CH3COOH与pH=12的NaOH溶液等体积混合
B.0.2 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合
C.CH3COOH溶液与NaOH溶液混合后所得溶液的pH=7
D.0.1 mol·L-1的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合