时间:2017-07-18 02:51:44
1、填空题 铝是国民经济发展的重要材料,铝在地壳中的含量约占8% ,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(I )实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1: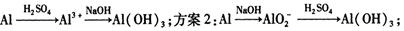
方案3: o
o
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案_____________________。
(II)工业上冶炼铝的流程图如图16所示:
在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe203质量分数的数据如下:
| ? | Al2O3 | Fe2O3 | 其他杂质 |
| 铝土矿 | 55% | 16% | — |
| 赤泥 | 15% | 48% | 一 |
参考答案:
本题解析:略
本题难度:一般
2、选择题 一定量的镁、铝合金,用足量的盐酸溶解后,再加入过量的NaOH溶液,然后滤出沉淀物,加热灼烧,得白色粉末,干燥后称量,这些粉末与原合金的质量相等,则合金中铝的质量分数是?
A.20%
B.40%
C.58.6%
D.60%
参考答案:B
本题解析:因为加入NaOH过量,所以生成的Al(OH)3又溶解,沉淀中仅有Mg(OH)2,最后粉末为MgO,Al在原合金中质量分数等于O在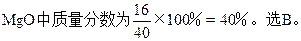
本题难度:一般
3、填空题 铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下图所示,请回答有关问题: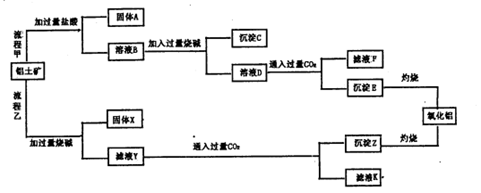
(1)流程乙加入烧碱后发生反应的离子方程式:?.
(2)溶液D到沉淀E发生的离子方程式:?。
(3)验证滤液B含Fe3+,可取少量滤液并加入?。
(4)滤液K中溶质的主要成份是?(填化学式)。
参考答案:(1)Al2O3+2OH-+3H2O=2[Al(OH)4]-;SiO2+2OH-=SiO32-+H2O?
(2)[Al(OH)4]-+CO2=HCO3-+ Al(OH)3↓(3)KSCN?(4)NaHCO3
本题解析:(1)氧化铁和氢氧化钠溶液不反应,氧化铝和二氧化硅与氢氧化钠溶液反应,所以有关反应的离子方程式是Al2O3+2OH-+3H2O=2[Al(OH)4]-、SiO2+2OH-=SiO32-+H2O。
(2)溶液B中含有铝离子,和过量的氢氧化钠溶液反应生成偏铝酸钠,然后再通入CO2则又生成氢氧化铝白色沉淀,反应的离子方程式是[Al(OH)4]-+CO2=HCO3-+ Al(OH)3↓。
(3)检验溶液中铁离子的试剂是KSCN溶液。
(4)由于滤液Y生成滤液K的试剂是过量的CO2气体,所以滤液K中溶质的主要成份是碳酸氢钠。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难易适中,侧重对学生基础知识的巩固与训练,同时也注重对学生答题能力的培养和方法指导。该题不仅可以考查学生对化学知识的熟悉理解程度,更重要的是培养学生的综合分析能力和思维方法。
本题难度:一般
4、选择题 欲使明矾溶液中的Al3+完全沉淀下来,适宜的试剂是:
A.NaOH溶液
B.盐酸
C.氨水
D.氯化钡溶液
参考答案:C
本题解析:本题能力层次为B,Al(OH)3是两性氢氧化物,能溶于酸和强碱溶液,用NaOH溶液和Al3+反应时,NaOH少量或过量都不能完全沉淀。答案是C;
学法指导:学习铝及其重要化合物的性质,重点把握“三价、两性、氧化膜”。 Al2O3、Al(OH)3呈两性,但它们不溶于弱碱溶液(如氨水)。制备Al(OH)3时,可用铝盐溶液和氨水反应。
本题难度:简单
5、选择题 相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是
[? ]
A.Al2O3
B.Al(OH)3
C.AlC13
D.Al
参考答案:D
本题解析:
本题难度:简单