时间:2017-07-18 02:37:01
1、填空题 化合物A是一种不稳定的物质,它的分子组成可用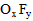 表示,10mL A气体能分解生成15mLO2和10mLF2
表示,10mL A气体能分解生成15mLO2和10mLF2
(同温同压下)
(1)A的分子式___________________;
(2)已知A分子中X个氧原子是…-O-O-O-…链状排列,则A分子的电子式____________________,结构式是_____________________。
参考答案:(1)O3F2
(2)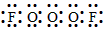 ;F-O-O-O-F
;F-O-O-O-F
本题解析:
本题难度:一般
2、选择题 下列叙述正确的是( )
A.若存在简单阴离子R2-,则R一定属于VIA族
B.阴离子的核外电子排布一定与上一周期稀有气体原子的核外电子排布相同
C.Na、Si、O的原子半径由大到小的顺序为:Na>O>Si
D.最外层电子数较少的金属元素,一定比最外层电子数较它多的金属元素活泼性强
参考答案:A.若存在简单阴离子R2-,其最低价为-2价,则最高价为+6价,最高价数等于族序数,则R一定属于VIA族,故A正确;
B.阴离子的核外电子排布中电子层数与原子的电子层数相同,则阴离子的核外电子排布一定与同一周期稀有气体原子的核外电子排布相同,故B错误;
C.电子层越多,半径越大,同周期从左向右原子半径在减小,则原子半径为Na>Si>O,故C错误;
D.同周期,最外层电子数较少的金属元素活泼性强,不同周期时,最外层电子数较少的金属元素不一定比最外层电子数较它多的金属元素活泼性强,故D错误;
故选A.
本题解析:
本题难度:简单
3、选择题 下列有关化学用语表示正确的是( )
A.四氯化碳分子比例模型:
B.次氯酸的结构式为H-Cl-O
C.COS的电子式是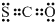
D.
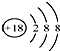
参考答案:A.Cl原子半径大于C原子,四氯化碳分子比例模型不正确,比例模型应符合原子的大小,故A错误;
B.因HClO为共价化合物,根据共价键成键的特点,氢原子形成一对共用电子对,氧原子形成两对共用电子对,氯原子形成一对共用电子对,其结构式为H-O-Cl,故B错误;
C.COS分子中碳原子与硫原子之间形成2对共用电子对,碳原子与氧原子之间形成2对共用电子对,COS的电子式是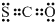 ,故C正确;
,故C正确;
D.氧原子核电荷数是8,818O2-粒子结构示意图: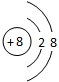 ,故D错误;
,故D错误;
故选:C;
本题解析:
本题难度:一般
4、选择题 关于氢键,下列说法正确的是?(?)
A.分子间形成的氢键使物质的熔点和沸点升高;
B.冰中存在氢键,水中不存在氢键;
C.每一个水分子内含有两个氢键;
D.H2O是一种非常稳定的化合物,这是由于氢键所致
参考答案:A
本题解析:氢键不是化学键,一般影响物质的物理性质,而不能影响分子的稳定性,A正确,D不正确。水分子间存在氢键,所以选项BC都是错误的,答案选A。
本题难度:一般
5、选择题 氯化钠是日常生活中人们常用的调味品.下列性质可以证明氯化钠中一定存在离子键的是(? )
A.具有较高的熔点
B.水溶液能导电
C.熔融状态能导电
D.常温下能溶于水
参考答案:C
本题解析:
本题难度:简单