时间:2017-07-18 02:37:01
1、填空题 氯化硼(BN)晶体是一种新型无机合成材料。用硼砂(Na2B4O7)和尿素反应可以得到氮化硼:Na2B4O7+ 2CO(NH2)2=4BN+Na2O +4H2O+2CO2↑,根据要求回答下列问题:
(1)组成反应物的所有元素中,第一电离能最大的是___________________。
(2)尿素分子( )中
)中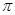 键与
键与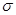 键数目之比为__________;尿素分子中处于同一平面的原子最多有_______个。
键数目之比为__________;尿素分子中处于同一平面的原子最多有_______个。
(3)尿素分子一定条件下形成六角形“超分子”(结构如图)。“超分子”中尿素分子间主要通过什么作用力结合。答:________________(填1种)。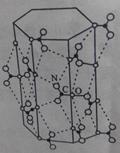
(4)图示“超分子”的纵轴方向有一“通道”。直链烷烃分子刚好能进人通道,并形成“超分子”的包台物;支链烷烃因含有测链,空间体积较大而无法进入“通道”。利用这一性质可以实现直链烷烃和支链烷烃的分离。
①直链烷烃分子能进人通道时,通过什么作用力与“超分子”结合,从而形成 “超分子”包合物?答:___________________。
②下列物质可以通过尿素“超分子”进行分离的是____________。
A.乙烷和丁烷? B.丁烷和异丁烷? C.异戊烷和新戊烷? D氯化钠和氯化钾
(5)BN晶体有a、B两种类型,且a—BN结构与石墨相似、B—BN结构与金刚石相似。
①a一BN晶体中N原子杂化方式是____________________;
②B—BN晶体中,每个硼原予形成________个共价键。这些共价键中,有________个为配位键。
参考答案:(1)N(2分)
(2)1︰7(2分)? 6(2分)
(3)氢键(2分)
(4)①范德华力(1分)?②B(1分)
(5)①sp2(1分)?②4? 1(各1分,共2分)
本题解析:(1)组成反应物的所有元素Na、B、O、C、N、H,非金属性越强第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以氮元素的第一电离能大于氧元素的,即组成反应物的所有元素中,第一电离能最大的是N。
(2)单键都是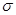 键,双键是由1个
键,双键是由1个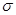 键和1个
键和1个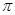 键构成的,所以根据尿素分子的结构简式
键构成的,所以根据尿素分子的结构简式 可知,分子中
可知,分子中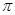 键与
键与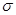 键数目之比为1︰7;由于碳氧双键是平面形结构,2个氮原子位于这个平面上。由于氨气是三角锥形结构,因此氨基中的2个氢原子最多有1个位于这个平面上,因此尿素分子中处于同一平面的原子最多有6个。
键数目之比为1︰7;由于碳氧双键是平面形结构,2个氮原子位于这个平面上。由于氨气是三角锥形结构,因此氨基中的2个氢原子最多有1个位于这个平面上,因此尿素分子中处于同一平面的原子最多有6个。
(3)尿素形成的晶体是分子晶体,而氧元素与氮元素均能形成氢键,所以“超分子”中尿素分子间主要通过氢键作用力结合。
(4)①烷烃形成的晶体类型是分子晶体,因此通过分子间作用力即范德华力与“超分子”结合,从而形成 “超分子”包合物。
②关节炎题意可知,可以实现直链烷烃和支链烷烃的分离,而乙烷和丁烷都不带支链,异戊烷和新戊烷均带支链,氯化钠和氯化钾不是烷烃,因此不能实现分离,丁烷和异丁烷分别是直链烷烃和支链烷烃,可以实现分离,答案选B。
(5)①a—BN结构与石墨相似,而石墨是层状结构,碳原子是sp2杂化,所以a一BN晶体中N原子杂化方式是sp2杂化。
②B—BN结构与金刚石相似,金刚石中每个碳原子形成4个共价键,所以B—BN晶体中,每个硼原予也形成4个共价键。由于B原子的最外层电子数是3个,只能形成3个共价键,因此这些共价键中,有1个为配位键。
本题难度:一般
2、简答题 X、Y、Z、W、Q五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,Z原子外围电子排布式为nsnnp2n,W原子核外的M层中只有两对成对电子,Q的核电荷数是Z与W的核电荷数之和.请回答下列问题:
(1)X、W的元素符号依次为______、______;
(2)写出Y2的电子式______;
(3)WZ2与XZ2分子的空间结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式);
(4)Q在元素周期表______区(填s、p、d、ds、f),其外围电子排布式为______,在形成化合物时它的最高化合价为______.
参考答案:X、Y、Z、W、Q五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,故L层有4个电子,故X为C元素;Z原子外围电子排布式为nsnnp2n,s能级最多容纳2个电子,故Z原子外围电子排布式为2s22p4,故Z为O元素;Y的原子序数介于C、O元素之间,故Y为N元素;W原子核外的M层中只有两对成对电子,则外围电子排布式为3s23p4,故W为S元素;Q的核电荷数是Z与W的核电荷数之和,故Q的核电荷数为8+16=24,为Cr元素.
(1)由上述分析可知,X为C元素,W为S元素.
故答案为:C;S.
(2)Y为N元素,氮气分子中N原子之间形成3对共用电子对,电子式为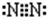 .
.
故答案为: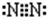 .
.
(3)WZ2为SO2,杂化轨道数为62=3,采取sp2杂化,含有1对孤对电子,故空间结构为V形;XZ2为CO2,杂化轨道数为42=2,采取sp杂化,没有对孤对电子,故空间结构为直线型;SO2是极性分子,CO2是非极性分子,水是极性分子,根据形似相溶原理,SO2在水中的溶解度较大.
故答案为:V形;直线型;SO2.
(4)Q的核电荷数为24,是Cr元素,处于周期表第四周期第ⅥB族,在元素周期表d区,其外围电子排布式为 3d54s1,在形成化合物时它的最高化合价为+6价.
故答案为:d;3d54s1;+6.
本题解析:
本题难度:一般
3、选择题 下列说法正确的是 (?)
A.H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。
B.HF、HCl、HBr、HI的熔点沸点依次升高。
C.乙醇分子与水分子之间只存在范德华力。
D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
参考答案:A
本题解析:A.H2O、H2S都是氧族元素形成的氢化物,结构相似,但是由于O元素的电负性大,原子半径小,所以在分子之间除了存在分子间作用力外,还存在氢键。增加了分子之间的相互作用,使得其熔沸点比与它相对分子质量大的H2S还高。正确。B.HF、HCl、HBr、HI也都是同族元素形成的氢化物。结构相似。一般情况下,结构相似的物质,相对分子质量越大,分子间的作用力就越大,物质的的熔点沸点就越高。但是由于F元素的电负性大,原子半径小,所以在分子之间除了存在分子间作用力外,还存在氢键。增加了分子之间的相互作用,使得其熔沸点要高很多。错误。C.乙醇分子与水分子之间除了存在范德华力外还存在氢键。错误。D.对同种元素形成的有氧酸之间的比较规律就是高价态的酸酸性强于低价态的酸的酸性。所以氯的各种含氧酸的酸性由强到弱排列为:HClO4> HClO3> HClO2>HClO。错误。
本题难度:一般
4、选择题 下列分子中,含有非极性键的化合物是(? )
A.H2
B.CO2
C.H2O
D.C2H4
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列说法正确的是( )
A.硼电负性和硅相近
B.π键是由两个p电子“头碰头”重叠形成的
C.原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数
D.组成和结构相似的物质随相对分子质量的增大,熔沸点升高,所以NO的沸点应该介于N2和O2之间
参考答案:A
本题解析:
本题难度:简单