时间:2017-07-18 02:33:20
1、选择题 已知:CO(g)+H2O(g)=CO2(g)+H2(g)△H=
参考答案:
本题解析:
本题难度:一般
2、选择题 下列图示与对应的叙述相符的是: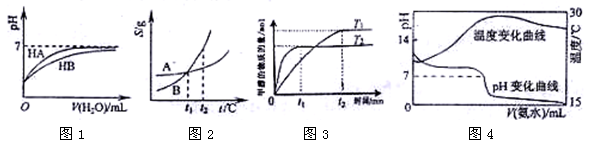
A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH。
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时 ,溶质的质量分数 B
参考答案:
本题解析:
本题难度:困难
3、选择题 如右图所示为冰的一种骨架形式,依此为单位向空间延伸,那么该冰中的每个水分子氢键个数为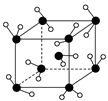
A.1
B.3
C.2
D.4
参考答案:C
本题解析:冰中平均每个水分子形成2个氢键,答案选C。
点评:该题基础性强,侧重考查学生灵活运用基础知识解决实际问题的能力,有利于调动学生的学习兴趣和学习积极性,激发学生的求知欲。
本题难度:简单
4、填空题 (16分)已知2SO2(g)十O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。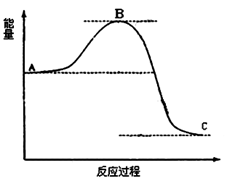
请回答下列问题:
(1)1mol SO2(g)氧化为1mol SO3(g)放出的热量为99.00kJ·mol-1,写出该反应的热化学方程式 。
(2)①在图中标出该反应的活化能E和反应热△H;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低,请在图中画图表示出来,并进行必要的标注。
(3)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 。
A.容器中气体总压强不变
B.容器中混合气体的密度不变
C.每生成1mol SO3的同时生成1molSO2
D.SO2、O2、SO3的物质的量之比为2∶1∶2
(4)在400℃,常压下,向体积为2L的密闭容器中充入2mol SO2(g)和1.92mol O2(g),充分反应后,测得还有0.08mol SO2剩余,求该反应的平衡常数(要求写出计算过程)。
参考答案:(1)2SO2(g)十O2(g) 2SO3(g) △H=-198.00 kJ/mo1 ;
2SO3(g) △H=-198.00 kJ/mo1 ;
(2) ①② ;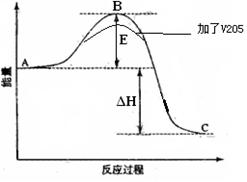
(3) A、C (4) K="1200L/mol"
本题解析: (1)1mol SO2(g)氧化为1mol SO3(g)放出的热量为99.00kJ·mol-1,则该反应的热化学方程式是2SO2(g)十O2(g) 2SO3(g) △H=-198.00 kJ/mo1;(2)①在图中标出该反应的活化能E和反应热△H如图:
2SO3(g) △H=-198.00 kJ/mo1;(2)①在图中标出该反应的活化能E和反应热△H如图: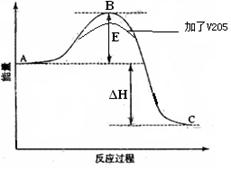 ;②该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,在图中画图表示出来,并进行必要的标注。(3)A.由于该反应是在恒温恒容的密闭容器内进行的。反应是气体体积减小的反应,所以若容器中气体总压强不变,则反应达到平衡,正确;B.反应前后气体的质量不变,容器的容积不变,所以无论反应是否达到平衡,容器中混合气体的密度都不变,因此不能作为判断平衡的标志,错误;C每生成1mol SO3就会消耗1mol的SO2,同时生成1molSO2,则SO2的物质的量浓度不变,反应达到平衡,正确;D.SO2、O2、SO3的物质的量之比为2∶1∶2是非常特殊的情况,这与加入的物质的多少有关,反应可能处于平衡状态,也可能未达到平衡,不能作为判断平衡的标志,错误。(4) 2SO2(g) 十 O2(g)
;②该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,在图中画图表示出来,并进行必要的标注。(3)A.由于该反应是在恒温恒容的密闭容器内进行的。反应是气体体积减小的反应,所以若容器中气体总压强不变,则反应达到平衡,正确;B.反应前后气体的质量不变,容器的容积不变,所以无论反应是否达到平衡,容器中混合气体的密度都不变,因此不能作为判断平衡的标志,错误;C每生成1mol SO3就会消耗1mol的SO2,同时生成1molSO2,则SO2的物质的量浓度不变,反应达到平衡,正确;D.SO2、O2、SO3的物质的量之比为2∶1∶2是非常特殊的情况,这与加入的物质的多少有关,反应可能处于平衡状态,也可能未达到平衡,不能作为判断平衡的标志,错误。(4) 2SO2(g) 十 O2(g) 2SO3(g)
2SO3(g)
C始(mol/L) 2mol/2L ="1mol/L" 1.92mol/2L=0.96mol/L 0
△C(mol/L) 0.96mol/L 0.48 0.96
C平(mol/L) 0.08mol/2L =0.04 0.48 0.96
K= C2(SO3)/C2(SO2) C(O2) = (0.96mol/L)2/(0.04mol/L)2×0.48mol/L =" 1200" L/mol
考点:考查热化学方程式的书写、反应热、活化能、反应速率的影响因素、可逆反应平衡状态的判断、化学平衡常数的计算的知识。
本题难度:一般
5、选择题 R2O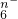 在一定条件下可以把Mn2+氧化成MnO
在一定条件下可以把Mn2+氧化成MnO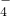 ,若反应后R2O
,若反应后R2O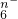 转变为RO
转变为RO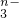 .又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值为
.又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值为
A.1
B.2
C.3
D.4
参考答案:B
本题解析:分析:Mn元素失去的电子数等于R元素得到的电子数(也可以通过化合价计算,Mn升高的化合价的数目等于R元素降低的化合价数目).
解答:反应中R元素化合价由 降低到6-n价,根据氧化剂和还原剂得失电子数目相等可知5×[
降低到6-n价,根据氧化剂和还原剂得失电子数目相等可知5×[ -(6-n)]×2=2×(7-2),n=2,
-(6-n)]×2=2×(7-2),n=2,
故选B.
点评:本题考查氧化还原反应的计算,注意从元素化合价变化的角度计算,明确元素的化合价为解答该题的关键.
本题难度:简单