时间:2017-07-18 02:28:10
1、选择题 某反应过程中体系的能量变化如图所示,下列说法错误的是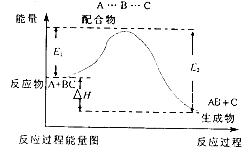
A.反应过程可表示为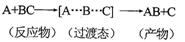
B.E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应为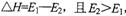 ,所以正反应为放热反应
,所以正反应为放热反应
D.此图中逆反应的热效应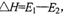 ,为吸热反应
,为吸热反应
参考答案:D
本题解析:A.由图象可知反应过程可表示为A+BC(反应物)→[A…B…C](过渡态)→AB+C(产物),A正确;B.反应物吸收一定能量成为活化分子,E1为正反应的活化能,B正确;C.正反应的热效应为△H=E1-E2,反应物总能量大于生成物总能量,则正反应放热,C正确;D.此图中逆反应的热效应△H=E2-E1,为吸热反应,D错误;选D。
考点:考查化学反应能量图像。
本题难度:一般
2、填空题 (14分)A、B、C、D为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如下表所述。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 工业上常用电解 91Exam.org熔融AD2制取A的单质。 | B的最外层电子数比最内层电子数多1。 | C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。 | D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。 |
参考答案:(1)MgCl2(熔融)电解Mg+Cl2↑ (2)2Al(s)+3Cl2(g)=2AlCl3(s) △H=-1676kJ/mol
(3)50;抑制SnCl2水解 (4)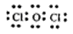 ;2HClO光照2H++2Cl-+O2↑
;2HClO光照2H++2Cl-+O2↑
(5)Al-3e-+4OH-=AlO2-+2H2O
本题解析:A、B、C、D为原子序数依次增大的四种第三周期元素,工业上常用电解熔融AD2制取A的单质,说明A应该是活泼的金属镁。B的最外层电子数比最内层电子数多1,因此B的原子序数是13,是铝元素。C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂,则C是硅元素。D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强,该弱酸性物质应该是次氯酸,即D是氯元素。甲的相对分子质量是3×29=87,所以甲是Cl2O。
(1)工业上电解熔融的氯化镁冶炼单质镁,反应的化学方程式为MgCl2(熔融)电解Mg+Cl2↑。
(2)13.5g的铝的物质的量是13.5g÷27g/mol=0.5mol,完全与氯气反应放出419 kJ的热量,因此2mol完全反应放出的热量是419 kJ×4=1676kJ,则反应的热化学方程式为2Al(s)+3Cl2(g)=2AlCl3(s) △H=-1676kJ/mol。
(3)Sn与元素硅同主族,周期数比元素硅的大2.则Sn的原子序数为14+18+18=50;+2价的锡在溶液中易水解,因此配制SnCl2溶液时需用盐酸溶解其晶体的目的是抑制SnCl2水解。
(4)甲中各原子都满足8电子稳定结构,这说明氧元素形成2对共用电子对,因此其电子式为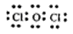 ;次氯酸不稳定,见光易分解生成氯化氢和氧气,所以溶液的酸性增强,反应的用离子方程式为2HClO光照2H++2Cl-+O2↑。
;次氯酸不稳定,见光易分解生成氯化氢和氧气,所以溶液的酸性增强,反应的用离子方程式为2HClO光照2H++2Cl-+O2↑。
(5)镁的金属性强于铝,但与氢氧化钠溶液反应的是铝,而不是镁,所以将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中镁是正极,铝是负极,负极反应的电极方程式为Al-3e-+4OH-=AlO2-+2H2O。
考点:考查元素推断、金属冶炼、热化学方程式、元素周期表的结构、电子式、次氯酸以及原电池原理等
本题难度:困难
3、填空题 (14分)A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、
D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶
液呈碱性,E与C的最外层电子数相同。
(1)画出D的原子结构示意图 ,E元素在周期表中的位置是 。
(2)A与C形成原子个数比为1:1的化合物甲,其中含有化学键类型为 。
(3)D与C按原子个数比为1:1形成化合物的电子式是 。
(4)B、C所形成氢化物的稳定性由强到弱的顺序是 (填具体的化学式)。
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与 C形成的化合物甲反应的离子方程式 。
(6)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式: ;放电时溶液中H+移向 (填“正”或“负”)极。
(7) E(s)+O2(g) EO2(g) △H1 E(g)+O2(g) EO2(g) △H2,则△Hl △H2(填“>”或“<”或“=”)。
参考答案:(共14分)(1)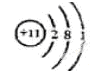 (1分)第三周期第VIA族(1分)
(1分)第三周期第VIA族(1分)
(2)共价键(1分)
(3)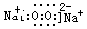 (2分)
(2分)
(4)H2O、NH3(2分)
(5)2Fe2++H2O2+2H+=2Fe3++H2O(2分)
(6)N2+6e-+8H+=2NH4+(2分) 正(1分)
(7)>(2分)
本题解析:(1)A、B组成的气态化合物的水溶液呈碱性,所以A是H元素,B是N元素,二者形成的化合物是氨气,水溶液呈碱性;A、[D都能与C按原子个数比为1:1或2:1形成化合物,则D是Na,C是O,形成的化合物氧化物与过氧化物均是原子个数比为1:1或2:1,E与C的最外层电子数相同,则E是S元素。D的原子结构示意图是 ,E在元素周期表则的位置是第三周期第VIA族;
,E在元素周期表则的位置是第三周期第VIA族;
(2)A与C形成原子个数比为1:1的化合物甲是过氧化氢,化学键类型是共价键;
(3)D与C按原子个数比为1:1形成化合物是过氧化钠,属于离子化合物,电子式为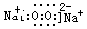 ;
;
(4)N的非金属性比O弱,所以B、C所形成氢化物水的稳定性大于氨气,稳定性由强到弱的顺序是H2O、NH3;
(5)F金属投入到盐酸溶液中,生成了浅绿色溶液M,则M是氯化亚铁,F是Fe,氯化亚铁与过氧化氢在酸性条件下发生氧化还原反应,生成铁离子和水,离子方程式为2Fe2++H2O2+2H+=2Fe3++H2O;
(6)以氢气、氮气为原料的电池的正极是氮气发生还原反应,结合电解质溶液氮气得电子与氢离子结合生成铵根离子,电极反应式为N2+6e-+8H+=2NH4+;原电池中的阳离子移向正极,所以放电时溶液中H+移向正极;
(7)固体熔化为液体需要吸热,所以气态S完全燃烧放出的热量多,则△Hl>△H2
考点:考查元素的判断,元素及其化合物的性质应用,电化学反应原理、热效应的判断
本题难度:一般
4、填空题 (3分)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应的是 (填序号),写出反应⑥的化学方程式__ ____。
参考答案:③ ④ ⑤ Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
本题解析:考查常见的放热反应和吸热反应。一般分解反应是吸热反应,氢气、CO和C与某些氧化物的反应是吸热反应,氢氧化钡晶体和氯化铵的反应是吸热反应。金属和水或酸的反应,燃烧反应,大部分化合反应,中和反应是放热反应。
本题难度:一般
5、填空题 工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。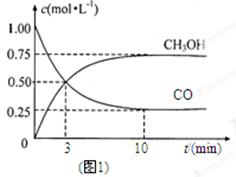
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)= ; H2的平衡转化率为_________________________。
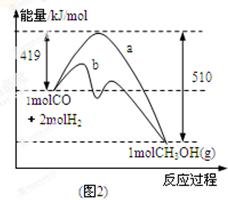
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。写出反应的热化学方程式 。
(3)该温度下,反应平衡常数K=______________(填数值),温度升高,平衡常数K_________(填“增大”、“不变”或“减小”)。
(4)恒容条件下,下列措施中能使反应体系中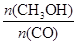 增大的措施有 。
增大的措施有 。
a.升高温度 b.充入He气 c.再充入2 molH2 d.使用催化剂
参考答案:(11分)
(1)0.075mol·L-1·min-1(2分) 0.75(或75%)(2分)
(2)CO(g) + 2H2(g)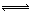 CH3OH(g) ΔH=-91 kJ·mol-1(2分)
CH3OH(g) ΔH=-91 kJ·mol-1(2分)
(3)4 mol-2·L-2(2分) 减小 (1分)
(4)C(2分)
本题解析:(1)由图可知,CO浓度变化量为1.00mol/L-0.25mol/L=0.75mol/L,△t=10min,则v(CO)=0.75mol/L÷10min=0.075mol/(L?min),氢气的平衡转化率为1.5/2=0.75。
(2)反应物的总能量为419kJ,生成物的总能量为510kJ,则该反应为放热反应,放出的热量为419kJ-510kJ=91kJ,热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol,该反应使用催化剂,只能改变反应的途径降低反应所需的活化能,而不能改变反应热,故答案为:放热;CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol;不能;
(3) CO(g)+2H2(g)?CH3OH(g)
初始浓度(mol/L): 1 2 0
转化浓度(mol/L): 0.75 1.5 0.75
平衡浓度(mol/L): 0.25 0.5 0.75
平衡常数K="0.75/(0.75" ×0.52 )=4mol-2·L-2
因该反应为放热反应,则升高温度,化学平衡逆向移动,K值减小;
(4)使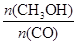 增大,化学平衡应正向移动,但升高温度时化学平衡逆向移动,恒容条件下充入He气化学平衡不移动,使用催化剂化学平衡不移动,在恒容条件下再充入1molCO和2molH2,压强增大,化学平衡正向移动,符合题意,故c正确,故答案为:c。
增大,化学平衡应正向移动,但升高温度时化学平衡逆向移动,恒容条件下充入He气化学平衡不移动,使用催化剂化学平衡不移动,在恒容条件下再充入1molCO和2molH2,压强增大,化学平衡正向移动,符合题意,故c正确,故答案为:c。
考点:本题考查的是化学原理知识,涉及化学反应速率计算、转化率计算、平衡常数的计算、热化学方程式的书写、平衡常数的应用等。
本题难度:困难