时间:2017-07-18 02:26:15
1、选择题 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 
[? ]
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
参考答案:C
本题解析:
本题难度:一般
2、填空题 甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为: CO(g)+2H2(g)  CH3OH (g) △H 1(反应Ⅰ)
CH3OH (g) △H 1(反应Ⅰ)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为:
CO(g)+ O2(g)=CO2(g) △H 2=-283 kJ·mol-
O2(g)=CO2(g) △H 2=-283 kJ·mol- 1 (反应Ⅱ)
1 (反应Ⅱ)
H2(g)+ O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C O O | H-O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
 O2(g)=CO2(g)+2H2O(g) △H4
O2(g)=CO2(g)+2H2O(g) △H4 O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
 学式)
学式)参考答案:(16分)⑴-116 kJ·mol-1 (2分)
⑵-651 kJ·mol-1 (2分)
单位体积供能多;密度大易于运输;单位产能耗氧量较少
(1分,其它合理答案均给分)
⑶K=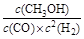 (1分)
(1分)
降低温度;增加反应气体的压强;将反应生成的甲醇及 时冷凝从反应体系中移去。
时冷凝从反应体系中移去。
(3分,其它合理答案均给分)
增加反应气体的压强 (1分,其它合理答案均给分)
⑷① 如图: (4分)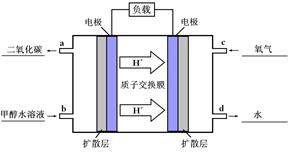
②CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+ (2分)
本题解析:略
本题难度:困难
3、选择题 汽车的启动电源常用铅蓄电池,放电时其电池反应如下:PbO2+Pb+2H2SO4="=" 2PbSO4+2H2O。根据此反应判断,下列叙述中正确的是
A.Pb是正极
B.PbO2得电子,被氧化
C.负极反应是Pb+SO42——2e—="=" PbSO4
D.电池放电时,溶液酸性增强
参考答案:C
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。根据反应式可知,铅失去电子,二氧化铅得到电子,所以铅是负极,二氧化铅是正极。选项C是错误的,答案选C。
本题难度:一般
4、选择题 已知空气、锌电池的电极反应为:锌片Zn+2OH--2e-=ZnO+H2O,石墨1/2O2十H2O+2e-=2OH-,由此判断锌片是
A.正极被还原
B.正极被氧化
C.负极被还原
D.负极被氧化
参考答案:D
本题解析:
本题难度:简单
5、选择题 如图所示为铜锌原电池,下列有关说法不正确的是( )
A.锌片作负极
B.铜片上有气泡
C.电子由铜片经导线流向锌片
D.一段时间后,溶液中氢离子的物质的量减小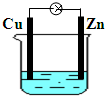
参考答案:A.该装置中锌易失电子作负极,故A正确;
B.铜作正极,正极上氢离子得电子生成氢气,所以Cu上有气泡生成,故B正确;
C.电子从负极沿导线流向正极,即电子从负极锌沿导线流向正极铜,故C错误;
D.正极上氢离子得电子发生还原反应生成氢气,所以一段时间后,溶液中氢离子的物质的量减小,故D正确;
故选C.
本题解析:
本题难度:简单