时间:2017-07-18 02:06:36
1、选择题 短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )
A.W2-、X+
B.X+、Y3+
C.Y3+、Z2-
D.X+、Z2-
参考答案:根据?短周期元素W、X、Y、Z的原子序数依次增大及各选项可以推出,W为O2-、X为Na+、Y为Al3+、Z为S2-,Al3+和S2-均能发生水解,水解打破了水的电离平衡;O2-不能在水溶液存在,而Na+不水解,故正确的是C;
故选C.
本题解析:
本题难度:一般
2、填空题 化合物SOCl2是一种液态化合物,沸点为77℃。在盛10ml水的锥形瓶中小心滴加8-10滴SOCl2可观察到剧烈反应,液面上形成白雾,并有刺激性气味的气体放出,该气体可使湿润的品红试纸褪色。在反应后的溶液中滴加AgNO3溶液,可生成一种不溶于稀HNO3的白色沉淀。
(1)试据上述实验事实,写出SOCl2与水反应的化学方程式?。
(2)将ZnCl2溶液蒸发至干,得不到无水ZnCl2,工业上常用ZnCl2?2H2O与SOCl2共热制取ZnCl2。试结合离子方程式解释原因:?。
(3)科学家经常利用 水解原理制备纳米材料,请写出用TiCl4制备TiO2·xH2O的化学方程式:?。
水解原理制备纳米材料,请写出用TiCl4制备TiO2·xH2O的化学方程式:?。
参考答案: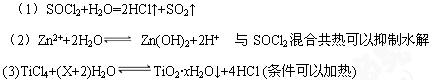
本题解析:略
本题难度:一般
3、填空题 常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图像回答下列问题: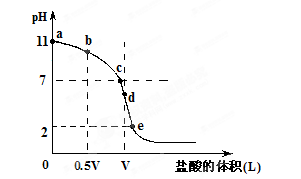 ?
?
(1)氨水的电离方程式为?,该温度时氨水的电离平衡常数K=?。
(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为?。
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有?。
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式)?。
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-)
B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=?,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为?。
参考答案:(1)NH3.H2O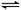 NH4++OH-(1分)? 10-5(1分)
NH4++OH-(1分)? 10-5(1分)
(2)d>c>b(2分)? (3)ACD(3分)? (4)D(2分)? (5)1(2分)? 11V/9(2分)
本题解析:(1)一水合氨是弱电解质,存在电离平衡,方程式为NH3.H2O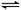 NH4++OH-。根据图像可知,0.1molL氨水中OH-浓度是0.001mol/L,所以电离平衡常数=
NH4++OH-。根据图像可知,0.1molL氨水中OH-浓度是0.001mol/L,所以电离平衡常数=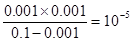 。
。
(2)当二者恰好反应时,溶液显酸性,所以bc两点氨水过量,抑制水的电离,d点恰好反应。水解促进水的电离。由于c点氨水的浓度小,所以b点抑制的程度大于c点,即水电离的c(OH-)大小顺序为d>c>b。
(3)A表示水的离子积常数,C表示氨水的电离平衡常数,均是不变的。水的离子积常数除以氨水的电离平衡常数即得到D,所以D中也不变的。由b点到c点的过程中,氢离子浓度增大,OH-浓度,所以选项C中是增大的。答案选ACD。
(4)b点氨水过量,溶液显碱性,根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)可知,选项A不正确。C点显中性,题意根据电荷守恒可知,c(Cl-)=c(NH4+),选项B不正确。D点恰好反应时,显酸性,应该是c(Cl-)>c(NH4+)>c(H+)>c(OH-),所以选项C也不正确。当氨水过量时,选项D是可以正确的,答案选D。
(5)恰好反应时,消耗盐酸的体积也是VL,所以盐酸的浓度也是0.1mol/L,因此pH=1。e点对应的pH=2,所以溶液中氢离子的浓度是0.01mol/L,则有 ,解得V1=11V/9。
,解得V1=11V/9。
本题难度:一般
4、选择题 物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其PH依次为10、9、8,则HX、HY、HZ的酸性由强到弱的顺序是(?)
A.HX>HZ>HY
B.HZ>HY>HX
C.HX>HY>HZ
D.HY>HX>HZ
参考答案:B
本题解析:根据盐类水解规律:越弱越水解,物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其PH依次为10、9、8,说明水解程度NaX、NaY、NaZ逐渐减弱,则酸性HZ>HY>HX,故B项正确。
本题难度:一般
5、选择题
A.所得混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.混合后溶液pH=7
C.所得混合液中存在c(CH3COOH)+ c(CH3COO-)=0.05mol/L
D.混合后溶液中存在c(CH3COOH)+c(CH3COO-)=c(Na+)+ c(H+)
参考答案:C
本题解析:醋酸与氢氧化钠恰好反应,得到醋酸钠溶液,由于少量醋酸根离子的水解,使Na+浓度略小于CH3COO-浓度,OH-浓度大于H+浓度,A、B错;利用Na元素守恒,可以计算出醋酸钠的浓度为0.05 mol/L,根据元素守恒,也可以判断,醋酸与醋酸根离子浓度之和也是0.05 mol/L,C对;醋酸根离子水解生成的醋酸分子与OH-离子物质的量相同,但溶液中还有来源于水电离出的氢氧根离子,根据电荷守恒可以判断,D错误。
本题难度:简单