时间:2017-07-18 02:05:31
1、选择题 根据酸碱质子理论,凡是能给出质子(即H+)的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照这种理论,下列微粒属于两性物质的是
A.ClO-
B.H2O
C.H2PO4-
D.NH4+
参考答案:BC
本题解析:根据题中所供信息,由于ClO-只能结合H+(即质子),NH4+只能给出H+,而H2O和H2PO4-既能给出H+又能结合H+:
H2O==H++OH-
H2O+H+==H3O+
H2PO4-==HPO42-+H+
H2PO4-+H+==H3PO4
因此,BC是两性物质。
本题难度:困难
2、选择题 下列反应既是化合反应,又是氧化还原反应的是
A.NaOH + HCl ="=" NaCl + H2O
B.2CO + O2点燃2CO2
C.H2 + CuO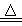 Cu + H2O
Cu + H2O
D.CaO + H2O ="=" Ca(OH)2
参考答案:B
本题解析:A、该反应是复分解反应,不是氧化还原反应,错误;B、该反应是化合反应,且C、O也是的化合价反应前后发生变化,又是氧化还原反应,正确;C、该反应是置换反应,是氧化还原反应,错误;D、该反应是化合反应,但元素的化合价不变,不是氧化还原反应,错误,答案选B。
考点:考查氧化还原反应与四种基本反应类型的判断
本题难度:一般
3、选择题 在外界提供相同电量的条件下,Cu2+或Ag+分别按Cu2++2e-=Cu 或Ag++e-=Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为
A.12.96g
B.3.24g
C.6.48g
D.1.62g
参考答案:C
本题解析:试题分析:析出铜的物质的量是1.92g÷64g/mol=0.03mol,转移电子的物质的量是0.03mol×2=0.06mol,则关键电子守恒可知,析出银的物质的量是0.06mol,质量是0.06mol×108g/mol=6.48g,答案选C。
考点:考查电解池中电极产物的有关计算
点评:该题是高考中的常见考点,难度不大。明确电子守恒是解题的关键,有利于培养学生的逻辑推理能力和规范答题能力。
本题难度:困难
4、选择题 某反应体系中存在下列六种物质:As2S3、HNO3、H2SO4、NO、H3AsO4和H2O,已知其中As2S3是反应物之一。下列说法不正确的是
A.该反应属于氧化还原反应
B.此反应中只有砷元素被氧化,只有氮元素被还原
C.HNO3、H2O是反应物,H2SO4、NO、H3AsO4是生成物
D.HNO3、H2SO4、H3AsO4都是最高价氧化物对应的水化物
参考答案:B
本题解析:根据“As2S3是反应物之一”,说明是H3AsO4、H2SO4生成物,反应前后As、S元素的化合价升高,进一步说明“HNO3是反应物,NO是生成物(反应前后N元素的化合价降低)”,从而判断B项错误。
考点:考查氧化还原反应原理。
本题难度:一般
5、选择题 在室温下等体积的酸和碱的溶液混合后,pH一定小于7的是
A.pH=3的硝酸跟pH=11的氢氧化钾溶液
B.pH=3的盐酸跟pH=11的氨水
C.0.1mol/LCH3COOH与0.1mol/LNaOH溶液
D.pH=3的醋酸跟pH=11的氢氧化钡溶液
参考答案:D
本题解析:试题分析:在室温下等体积的酸和碱的溶液混合, A.pH=3的硝酸跟pH=11的氢氧化钾溶液混合后,pH=7;B.pH=3的盐酸跟pH=11的氨水pH大于7;C.0.1mol/LCH3COOH与0.1mol/LNaOH溶液考点,pH=3的盐酸跟pH=11的氨水pH大于7;D.pH=3的醋酸跟pH=11的氢氧化钡溶液,pH一定小于7。
考点:酸碱混合时的定性判断及有关pH的计算
点评:pH=3的弱酸与pH=3的强酸,所对应的一元酸的浓度前者大于后者。
本题难度:困难