时间:2017-07-18 01:59:59
1、判断题 工业制镁是采用电解熔融的氯化镁的方法。试分析电解熔融的MgCl2的原理,写出有关的电极反应式及总反应式。
参考答案:阳极 2Cl-→Cl2↑+2e-;阴极Mg2++2e-=Mg。总反应式为:MgCl2 ?Mg + Cl2↑。
?Mg + Cl2↑。
本题解析:熔融的氯化镁中自由移动的Mg2+和Cl-,其中Cl-定向向阳极移动,在阳极上发生氧化反应:2Cl-→Cl2↑+2e-;Mg2+定向向阴极移动,在阴极上发生还原反应:Mg2++2e-=Mg。总反应式为:MgCl2 Mg + Cl2↑。
Mg + Cl2↑。
本题难度:一般
2、选择题 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)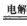 4Na +O2↑+2H2O; 后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe +4NaOH
4Na +O2↑+2H2O; 后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe +4NaOH Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
[? ]
A.若戴维法与盖·吕萨克法制得等量的钠,则反应中前者转移电子总数小于后者
B.工业上还可以用石墨作阳极,铁作阴极电解氯化钠溶液制钠
C.戴维法制钠,阳极发生电极反应为2OH-+2e-=H2↑+O2↑
D.盖·吕萨克法制钠原理是利用铁的还原性比钠的强
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列关于铜电极的叙述中正确的是
[? ]
A.铜锌原电池中铜作负极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时用金属铜作阳极
D.电解饱和食盐水制氯气时用铜作阳极
参考答案:C
本题解析:
本题难度:简单
4、选择题 用铂电极电解CuSO4和KNO3的混合溶液500 mL,经过一段时间后,两极均得到标准状况下11.2 L的气体,则原混合溶液中CuSO4的物质的量浓度为(? )
A.0.5 mol?L-1
B.0.8 mol?L-1
C.1.0 mol?L-1
D.1.5 mol?L-1
参考答案:C
本题解析:阳极发生电极反应:4OH--4e-=2H2O+O2↑,失去电子的物质的量=n(O2)×4="(11.2/22.4)×4" mol="2" mol;阴极发生电极反应:首先发生的是Cu2++2e-=Cu,其次是2H++2e-=H2↑,阴极得到电子的物质的量=n(Cu2+)×2+n(H2)×2=n(Cu2+)×2+(11.2/22.4)×2mol,两电极物质得失电子数相等,即2 mol=n(Cu2+)×2+(11.2/22.4)×2 mol。解得n(Cu2+)="0.5" mol,n(CuSO4)=n(Cu2+)="0.5" mol,其物质的量浓度="0.5" mol/(500×10-3L)="1.0" mol·L-1,答案为C。
本题难度:一般
5、选择题 用铂电极电解CuSO4溶液,当Cu2+浓度降至一半时停止通电,若使CuSO4溶液恢复到原浓度,应加入的物质是()
A.CuSO4
B.CuO
C.Cu(OH)2
D.CuSO4·H2O
参考答案:B
本题解析:发生的电解池反应为2CuSO4+2H2O 2Cu↓+O2↑+2H2SO4,电解中CuSO4溶液每损失2个Cu原子,就损失2个O原子,相当于损失CuO。为了使CuSO4溶液恢复原浓度,显然应加入CuO。
2Cu↓+O2↑+2H2SO4,电解中CuSO4溶液每损失2个Cu原子,就损失2个O原子,相当于损失CuO。为了使CuSO4溶液恢复原浓度,显然应加入CuO。
本题难度:简单