时间:2017-07-18 01:55:16
1、选择题 从经济效益和环境保护的观点出发,由铜制取硝酸铜最适宜的方法是(?)
参考答案:C
本题解析:略
本题难度:简单
2、选择题 现在,我国用量最多、用途最广的合金是
A.钢
B.青铜
C.铝合金
D.塑料制品
参考答案:A
本题解析:塑料制品应用虽然十分广泛,但不属合金,D选项被排除。青铜制品,现在使用较少,B选项被排除。钢和铝合金都是到处可见的,由于韧性较好,强度大、用量最多的是钢,用途最广的也是钢。
本题难度:一般
3、选择题 取少量MgO、A12O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到沉淀X和滤液Y。下列叙述正确的是
[? ]
A.上述四种氧化物对应的水化物中,Al(OH)3酸性最强
B.向沉淀X中逐滴加入硝酸,沉淀慢慢溶解
C.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
D.溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2
参考答案:C
本题解析:
本题难度:简单
4、实验题 (12分)
实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
(1)如何检查装置A的气密性?
(2)为了安全,在点燃D处的酒精灯之前,在b处必须?。
(3)装置B的作用是?
装置C中装的液体是?
(4)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生的化学反应方程式是??
(5)若FeO和Fe2O3固体混合物的质量为23. 2g,反应完全后,U型管的质量增加7.2g则混合物中Fe2O3的质量为?_。
参考答案:(12分)
(1)开启旋塞,向长颈漏斗中加水。当水充满容器下部的半球体时,关闭旋塞。继续加水,使水上升到长颈漏斗中。静置片刻,若水面不下降,则说明装置气密性良好
(2)验纯
(3)除HCl、浓H2SO4
(4)Fe2O3+3H2=2Fe+3H2O? FeO+H2=Fe+H2O
(5)16g
本题解析:考查了气体的制取和物质的测定的相关实验操作
(3)装置B、C为气体的净化装置,分别除去氢气里的HCl及水蒸汽。
(4)根据混合物的质量及产物水的质量列出方程组计算即可。
本题难度:一般
5、填空题 (16分)金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:
(2)一定温度下,氧化铁可以与一氧化碳发生如下反应: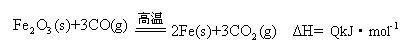
①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为?;
②达平衡后,若温度升高,的值增大,则Q?0(填“>”、“=”、“<”)。
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为?(填序号)。?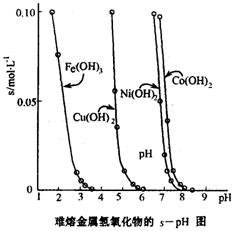
A.小于l? B.4左右? C.大于6? D.大于9
(4)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)=?:?:?。
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是?(填序号)。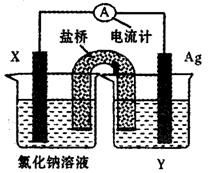
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
D.原电池工作时,x电极反应为:O2+2H2O+4e-→4OH-
参考答案:(1)-824.4KJ/mol
(2)?①0.03mol·L-1·min-1?②<
(3)①B
(4)6.3:3.4×10-10:6.4×10-35或6.3×1035:3.4×1025:6.4
(5)BD
本题解析:略
本题难度:简单