时间:2017-07-18 01:33:47
1、选择题 实现下列变化时,需克服相同类型作用力的是?
[ ? ]
A、二氧化硅和干冰的熔化
B、液溴和钠的气化
C、食盐和冰的熔化
D、纯碱和烧碱的熔化
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列含有同一元素的含氧酸中酸性强弱比较正确的是( )?
A.H2SO3>H2SO4?
B.HNO3>HNO2?
C.H3PO3>HPO3?
D.HClO>HClO4
参考答案:BC?
本题解析:同种元素的不同价态的无机含氧酸,价态越高,酸性越强。?
本题难度:简单
3、选择题 若N60是与C60相似的另一种“分子足球”,下列说法正确的是
A.N60分子中只含有共价键
B.N60和14N都是氮的同位素
C.N60是一种新型化合物
D.N60与N2互为同分异构体
参考答案:A
本题解析:略
本题难度:一般
4、选择题 下列关于化学用语的理解正确的是( )
A.HClO的电子式: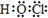
B.乙醛的结构简式为CH3CH2OH
C.比例模型 表示CH4分子或CCl4分子
表示CH4分子或CCl4分子
D.Cl-离子的结构示意图: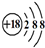
参考答案:A.次氯酸的中心原为O原子,分子中存在1个氧氢键和1个氧氯键,次氯酸的电子式为: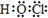 ,故A正确;
,故A正确;
B.CH3CH2OH为乙醇结构简式,乙醛分子中的官能团为醛基,乙醛正确的结构简式为:CH3CHO,故B错误;
C. 可以表示甲烷的比例模型,而四氯化碳分子中氯原子的原子半径大于碳原子,四氯化碳的比例模型为:
可以表示甲烷的比例模型,而四氯化碳分子中氯原子的原子半径大于碳原子,四氯化碳的比例模型为: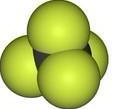 ,故C错误;
,故C错误;
D.氯离子的核电荷数为17,离子核外3个电子层,核外电子总数为18,氯离子的结构示意图为: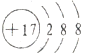 ,故D错误;
,故D错误;
故选A.
本题解析:
本题难度:一般
5、选择题 类推的思维方法在化学学习与研究中常会产生错误的结论。因此类推出的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是?(?)?
A.从CCl4、NH4+为正四面体结构,可推测SiCl4、PH4+也为正四面体结构
B.NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
C.CO2为非极性分子,故SiO2也为非极性分子
D.CO2通入Ca(ClO)2溶液生成CaCO3和HClO,故通入SO2生成CaSO3和HClO
参考答案:A
本题解析:略
本题难度:一般