时间:2017-07-18 01:27:36
1、简答题 二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10.0MPa,温度230~280℃)进行的反应为:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1,
(1)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=______.
(2)在温度和容积不变的条件下发生反应①,能说明该反应达到化学平衡状态的依据是______(多选扣分).
a.容器中压强保持不变;b.混合气体中c(CO)不变;c.v正(CO)=v逆(H2);d.c(CH3OH)=c(CO)
(3)在2L的容器中加入amo1CH3OH(g)发生反应②,达到平衡后若再加入amo1CH3OH(g)重新达到平衡时,CH3OH的转化率______(填“增大”、“减小”或“不变”).
(4)850℃时在一体积为10L的容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示.
①0~4min的平均反应速率υ(CO)=______.
②若温度不变,向该容器中加入4mo1CO、2mo1H2O、3mo1CO2(g)和3mo1H2(g),起始时D正______V逆(填“<”、“>”或“=”),请结合必要的计算说明理由______.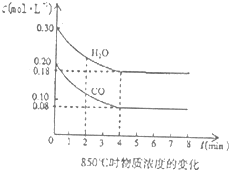
参考答案:(1)①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1,
依据盖斯定律①×2+②+③:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=-246.1KJ/mol;
故答案为:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=-246.1KJ/mol;
(2)CO(g)+2H2(g)?CH3OH(g),反应是气体体积减小的放热反应;
a.反应前后气体体积变化,容器中压强保持不变,证明反应达到平衡,故a正确;
b.平衡状态的标志是物质浓度 保持不变,混合气体中c(CO)不变说明反应达到平衡,故b正确;
c.依据化学方程式反应达到平衡时2v正(CO)=v逆(H2)证明反应达到平衡,故C错误;
d.反应过程中c(CH3OH)=c(CO)说明剩余一氧化碳和生成甲醇浓度相同,但不能证明正逆反应速率相同,故d错误;
故答案为:ab;
(3)在2L的容器中加入amo1CH3OH(g)发生反应②,反应前后气体体积不变,达到平衡后若再加入amo1CH3OH(g)相当于增大压强,平衡不变,CH3OH的转化率不变
故答案为:不变;
(4)①图象分析平衡后一氧化碳浓度变化为0.2mol/L-0.08mol/L=0.12mol/L;V(CO)=0.12mol/L4min=0.03mol/L?min;
故答案为:0.03mol/L?min;
②若温度不变,向该容器中加入4mo1CO、2mo1H2O、3mo1CO2(g)和3mo1H2(g),Qc=0.3,mol/L×0,3mol/L0.4mol/L×0.2mol/L=98,K=0.12mol/L×0.12mol/L0.08mol/L×0.18mol/L=1
因为Qc>K,平衡左移,V正<V逆
故答案为:<;因为Qc>K,平衡左移,所以V正<V逆.
本题解析:
本题难度:一般
2、选择题 已知在298K时下述反应的有关数据:C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ/mol
C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol;则C(s)+CO2(g)=2CO(g) 的△H为
[? ]
A.283.5kJ/mol
B.172.5kJ/mol
C.-172.5kJ/mol
D.-504 kJ/mol
参考答案:B
本题解析:
本题难度:一般
3、填空题 已知下列三个热化学方程式
①H2(g)+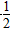 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
③C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131 kJ·mol-1
写出表示碳燃烧生成CO和CO燃烧生成CO2的燃烧热的热化学方程式。 _________________________________________; _________________________________________。
参考答案:C(s)+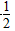 O2(g)===CO(g) ΔH=-110.8 kJ·mol-1
O2(g)===CO(g) ΔH=-110.8 kJ·mol-1
CO (g)+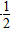 O2(g)===CO2(g) ΔH=-282.7 kJ·mol-1
O2(g)===CO2(g) ΔH=-282.7 kJ·mol-1
本题解析:
本题难度:一般
4、选择题 下列关于盖斯定律的说法不正确的是( )
A.不管反应是一步完成还是分几步完成,其反应热相同
B.反应热只与反应体系的始态和终态有关,而与反应的途径无关
C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到
D.根据盖斯定律,热化学方程式中△H直接相加即可得总反应热
参考答案:D
本题解析:
本题难度:一般
5、填空题 研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。
已知:
①CO(g)+?1/2O2(g)=CO2(g)?△H=-283.0kJ/mol?
②S(s)+?O2(g)=SO2(g)?△H=-296.0kJ/mol?
此反应的热化学方程式是___________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知: ?
①?CO(g)+NO2(g)=NO(g)+CO2(g)?△H=-akJ/mol?(a>0) ?
②?2CO(g)+2NO(g)=N2(g)+2CO2(g)?△H=-bkJ/mol?(b>0)
若用标准状况下?3.36LCO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为_______mol,放出的热量为________kJ(用含有a和b的代数式表示)。
(3)用CH4 催化还原NOx也可以消除氮氧化物的污染。例如: ?
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H1=-574kJ/mol?① ?
②CH4(g)+4NO?(g)=2N2(g)+CO2(g)+2H2O(g)?△H2=?②
若1molCH4还原NO2至N2整个过程中放出的热量为867KJ,则△H2=_________。
参考答案:(1)2CO(g )+SO2(g) =S(s)+2CO2(g)?△H1=-270kJ/mol
(2)0.3;3(2a+b)/80
(3)-1160kJ/mol
本题解析:
本题难度:一般