时间:2017-07-18 01:23:35
1、填空题 (1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为___________;O22+中键数目和键数目之为________。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为__________;Cu+的配位数为__________。
(3)乙炔与氢氰酸反应可得丙烯腈。丙烯腈分子中碳原子轨道杂化类型是_______________。
(4)在合成氨反应中,催化剂铁表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比为
_______。 
参考答案:(1)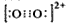 ;1:2
;1:2
(2)1s22s22p63s23p63d10;2
(3)sp、sp2
(4)1:2
本题解析:
本题难度:一般
2、简答题 (1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ-mol-1) | I1 | I2 | I3 | I4 A 932 1821 15390 21771 B 738 1451 7733 10540 |
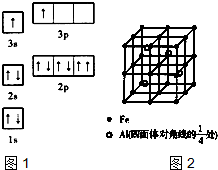
参考答案:(1)①由图1电子轨道排布图可知,3s能级未填满就填充3p能级,2p能级的轨道内有自旋方向相同的2个电子,所以违背能量最低原理与泡利原理.由表中电离能可知,二者第三电离能剧增,故为+2价,都为短周期元素,故A为铍、B为Mg,镁价层电子排布为3s2,处于周期表中S区,
故答案为:能量最低原理、泡利原理;S;
②BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型,故答案为:SP;直线;
(2)①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对,故答案为:具有孤对电子;
②六氰合亚铁离子[Fe(CN)6]4-中Fe2+与CN-形成配位键,CN-中存在C≡N三键,为极性共价键,三键中有1个σ键2个π键,所以CN-中共价键、配位键、σ键、π键;CN-中C原子与1个单位负电荷用N原子替换可得CN-等电子体的单质为N2,故答案为:B;N2;
(3)①由晶胞图2,晶胞中含有4个Al原子,且都位于晶胞内部,则晶胞平均含有4个Al,晶胞中Fe位于顶点的有8个,位于面心的有6个,位于棱上的有12个,位于体心的有1个,含有Fe原子数目为8×18+6×12+12×14+1=8,Fe与 Al原子数目之比为8:4=2:1,故该合金的化学式为Fe2Al,故答案为:Fe2Al;
②一个晶胞中含有8个Fe原子和4个Al原子,晶胞的质量为56×8+27×4NAg,棱长为
本题解析:
本题难度:一般
3、选择题 顺式Pt(NH3)2Cl2相对分子质量为300。是临床广泛使用的抗肿瘤药物。下列有关该物质的说法中正确的是
[? ]
A.由4种元素组成
B.含有NH3分子
C.Pt的化合价为+4
D.Pt元素的质量分数为65%
参考答案:AD
本题解析:
本题难度:简单
4、填空题 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式_______________________。
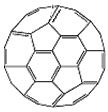
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯
(C60)的结构如图,分子中碳原子轨道的杂化类型为_____________;1 mol C60分子中σ键的数目为
_____________。 
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
① 第一电离能:As________Se(填“>”、“<”或“=”)。
②硫化锌的晶胞中(结构如下图所示),硫离子的配位数是__________。
③二氧化硒分子的空间构型为________。?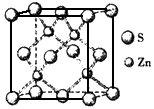
(4)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图,请在下图中用箭头表示出配位键。
参考答案:(1)1s22s22p63s23p63d84s2
(2)sp2;90NA
(3)①>;②4 ;③折线型 (4)
本题解析:
本题难度:一般
5、选择题 向盛有硝酸银水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到无色的透明溶液.下列对此现象说法正确的是( ? )
A.反应后溶液中不存在任何沉淀,所以反应前后Ag+的浓度不变
B.沉淀溶解后,生成的无色配合离子[Ag(NH3)2]+一定难电离
C.向反应后的溶液中加入过量盐酸,无任何现象发生
D.在[Ag(NH3)2]+离子中,既存在离子键,又存在共价键
参考答案:B
本题解析:
本题难度:一般