时间:2017-07-18 01:14:42
1、填空题 (2分)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)==c(M+),而乙同学认为c(A-)与 c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为 同学的说法正确,理由是 。
参考答案:甲;依溶液中的电荷守恒:c(M+)+c(H+)=c(A+)+c(OH-) ,因溶液呈中性则有: c(H+)=c(OH-) ,固有c(M+)=c(A+)
c(H+)=c(OH-) ,固有c(M+)=c(A+)
本题解析:略
本题难度:一般
2、简答题 要使饱和H2S溶液pH增大的同时,[S2─]减小,可向溶液中加入适量?①NaOH溶液;②水;③SO2;④CuSO4固体;⑤盐酸( )
A.①③⑤
B.②④⑤
C.②③
D.③④⑤
参考答案:由题意知,氢离子浓度减小,硫离子浓度减小,H2S?H++HS-、HS-?S2-+H+平衡向逆反应方向移动,
?①加入NaOH溶液,氢氧根离子中和氢离子,氢离子浓度减小,平衡向正反应方向移动,但硫离子浓度增大,不符合题意,故①错误;
②加入水,平衡向正反应方向移动,但氢离子和硫离子浓度都减小,故②正确;
③加入SO2,SO2+2H2S=3S+2H2O,平衡向逆反应方向移动,氢离子和硫离子浓度都减小,故③正确;
④加入CuSO4固体,Cu2++S2-=CuS↓,平衡向正反应方向移动,氢离子浓度增大,硫离子浓度减小,故④错误;
⑤加入盐酸,平衡向逆反应方向移动,硫离子浓度降低,但氢离子浓度增大,故⑤错误.
故选C.
本题解析:
本题难度:一般
3、选择题 向1LpH=2的盐酸和醋酸溶液中,分别投入0.65g锌粒,则图中比较符合客观事实的是( )
A.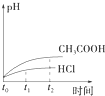
B.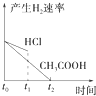
C.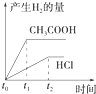
D.
参考答案:C
本题解析:
本题难度:一般
4、填空题 25℃时,氢硫酸(H2S)饱和溶液的浓度为0.1mol?L-1,写出氢硫酸在溶液中的电离方程式______.若此时溶液的pH=4,向该溶液中滴入甲基橙试液,溶液显______色.将变色后的溶液分成A、B、C三份,分别进行下列实验:
(1)向A溶液中加入等体积的CuSO4溶液,恰好完全反应,反应的离子方程式为______,静置后的澄清的溶液呈______
______色;
(2)向B溶液中加入适量的碘水,恰好完全反应,反应的离子方程式为______,假设溶液的体积增大一倍,此时溶液的pH约为______;
(3)向C溶液中加入少量Na2S晶体,振荡后溶液的pH将______(填“增大”、“减小”或“不变”).
参考答案:硫化氢是二元弱酸,在水溶液里分步电离,第一步电离方程式为:H2S?HS-+H+,第二步电离方程式为:HS-?S2-+H+,甲基橙的变色范围是3.1-4.4,若溶液的pH=4,则向溶液中加入甲基橙,溶液呈橙色,
故答案为:H2S?HS-+H+、HS-?S2-+H+;橙;
(1)硫化氢和硫酸铜反应生成硫酸和硫化铜黑色沉淀,离子反应方程式为:H2S+Cu2+=2H++CuS↓,溶液由弱酸变成强酸,氢离子浓度是0.1mol?L-1,则溶液的pH=1,加入甲基橙后溶液呈红色,故答案为:H2S+Cu2+=2H++CuS↓;红;
(2)碘和硫化氢反应生成硫单质和氢碘酸,离子反应方程式为:H2S+I2=2H++2I-+S↓,氢碘酸是强酸,氢离子浓度是0.1mol?L-1,则溶液的pH=1,故答案为:H2S+I2=2H++2I-+S↓;1;
(3)向硫化氢溶液中加入硫化钠固体,硫离子浓度增大,抑制硫化氢电离,导致溶液中氢离子浓度减小,所以pH增大,故答案为:增大.
本题解析:
本题难度:简单
5、选择题 在氨水中存在下列电离平衡:NH3·H2O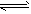 NH4++OH-,下列情况能引起电离平衡向正向移动的有
NH4++OH-,下列情况能引起电离平衡向正向移动的有
[? ]
①加NH4Cl固体 ②加NaOH溶液 ③加HCl ④加CH3COOH溶液 ⑤加水 ⑥加压
A.①③⑤
B.①④⑥
C.③④⑤
D.①②④
参考答案:C
本题解析:
本题难度:一般