时间:2017-07-18 01:00:21
1、选择题 下列变化过程放热的是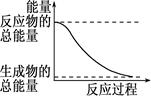
A.H2O(l)→H2O(g)
B.2HI(g)→H2(g)+I2(g)+QQ=—14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如上图所示的化学反应
参考答案:D
本题解析:A、物质从液态变为气态需要吸收热量,错误;B、Q<0表示吸热反应,错误;C、形成化学键放出热量,但断键时吸收热量,二者的差值无法计算,所以不能判断反应是否是放热反应,错误;D、反应物的总能量大于生成物的总能量,则该反应一定是放热反应,正确,答案选D。
考点:考查放热和吸热反应的判断
本题难度:一般
2、选择题 下列与化学反应能量变化相关的叙述正确的是( )
A.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
B.等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),放出的能量相同
C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D.氢气的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)=2H2(g) + O2(g) ΔH=+ 571.6 kJ·mol-1
参考答案:D
本题解析:A、NaOH溶于水放热,所以则向含0.1molHCl的盐酸中加入4.0gNaOH固体,放出热量大于5.73kJ,故A错误;B、氢气和氧气反应生成液态水比生成水蒸气放热多,故B错误;C、反应热的大小与反应条件无关,所以同温同压下氢气和氯气载光照和点燃条件下焓变相同,故C错误;D、一个化学反应与其逆反应的反应热数值相同,符号不同,故D正确。
考点:本题考查化学反应与能量转化。
本题难度:一般
3、选择题 下列反应中,既有共价键的断裂,又有离子键的形成的是( )
A.盐酸和氢氧化钠溶液反应
B.氯化氢气体溶解于水
C.氯化氢气体遇到氨气产生“白烟”
D.锌片投入稀硫酸中产生气体
参考答案:C ?
本题解析:溶于水的过程中,离子键会断裂,在溶液中进行的反应,无离子键的形成。
本题难度:一般
4、选择题 下列物质中,既含离子键、又含共价键的是( )
A.NaOH
B.Na2O
C.NH4Cl
D.CaCl2
参考答案:A、NaOH为离子化合物,含有离子键,OH-离子中含有共价键,故A正确;
B、Na2O只含有离子键,故B错误;
C、NH4Cl为离子化合物,含有离子键,NH4+离子中含有共价键,故C正确;
D、CaCl2只含有离子键,故D错误.
故选AC.
本题解析:
本题难度:简单
5、选择题 已知氢气在氯气中燃烧时产生苍白色火焰,在反应过程中,破坏1mol氢气的化学键消耗的能量为Q1kJ,破坏1mol氯气的化学键消耗的能量为Q2kJ,形成1mol氯化氢中的化学键释放的能量为Q3kJ,下列关系式正确的是
[? ]
参考答案:D
本题解析:
本题难度:一般