时间:2017-07-18 00:56:20
1、简答题 下列性质的比较,正确的是( )
A.酸性:H2SiO3>H2CO3
B.碱性:Mg(OH)2>Al(OH)3
C.稳定性:H2S>HCl
D.原子半径:N>C
参考答案:A.非金属性C>Si,元素非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:H2CO3>H2SiO3,故A错误;
B.金属性Mg>Al,元素金属性越强,对应的最高价氧化物的水化物的碱性越强,则Mg(OH)2>Al(OH)3,故B正确;
C.非金属性Cl>S,元素非金属性越强,对应的氢化物越稳定,则稳定性:HCl>H2S,故C错误;
D.同周期元素从左到右原子半径逐渐减小,原子半径C>N,故D错误.
故选B.
本题解析:
本题难度:一般
2、填空题 下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号.请参照元素A~J在周期表中的位置,回答下列问题:
| 纵行 横行 | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 1 A 2 B C D 3 F G H E I J |
参考答案:表格中A为H,B为C,C为N,D为O,E为S,F为Na,G为Al,H为Si,I为Cl,J为Ar.
(1)在元素周期表中同主族从上到下,金属性逐渐增强,非金属性逐渐减弱,同一周期从左到右金属性逐渐减弱,非金属性逐渐增强,故最左下角的F元素Na金属性最强,对应的最高价氧化物对应水化物的碱性最强故为NaOH,非金属性最强的为I,为Cl,其最高价氧化物对应的水化物酸性最强,故酸性最强的为HClO4
故答案为:NaOH; HClO4 ;
(2)J为Ar,为18号元素,故其原子结构示意图为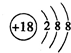
,C为N,位于元素周期表的第二周期,第VA族;
故答案为:
; VA;
(3)N元素的氢化物为氨气,是一种碱性气体,最高价氧化物对应水化物为强酸,两者可发生中和反应,故此元素为N;?
故答案为:N;?
(4)D为O,E为S,F为Na,G为Al,对应的离子为 02-,S2-,Na+,Al3+,其中S2-为18电子构型,其余均为10电子,故S2-半径最大,当核外电子数相同时,离子的核电荷数越大,离子半径越小,核电荷数铝>钠>氧,
故离子半径S2->02->Na+>Al3+;
故答案为:S2->02->Na+>Al3+;
(5)G为Al,电解精炼铝的化学方程式为2Al2O3?电解?.?4Al+302;A为H,D为O,E为S,F为Na,都含有A、F、D、E四种元素的两种盐溶液,可以相互反应,符合条件的是亚硫酸氢钠和硫酸氢钠,亚硫酸氢钠为一种酸式盐,硫酸氢钠可以完全电离出氢离子,可以反应生成二氧化硫和水,反应方程式如下:
NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O
故答案为:2Al2O3?电解?.?4Al+302 NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O;?
(6)B为C,C为N,证明其非金属性强弱可以有很多方法,如对应氢化物的稳定性,最高价氧化物对应水化物的酸性等,其中酸性比较可以用硝酸与碳酸钠反应生成硝酸钠和二氧化碳、水,二氧化碳和水即为碳酸,强酸制取弱酸,故硝酸酸性强,反应方程式为2HNO3+Na2CO3=2NaNO3+H2O+CO2↑
故答案为:2HNO3+Na2CO3=2NaNO3+H2O+CO2↑
(7)G为Al元素既表现金属性又有一定的非金属性,向AlCl3溶液中逐渐滴加NaOH溶液,有白色沉淀析出,说明铝元素具有金属性,然后又逐渐溶解说明其具有非金属性,反应的方程式可以分段书写为:
Al3++3OH-=Al(OH)3↓; Al(OH)3+OH-=[Al(OH)4]-
故答案为:向AlCl3溶液中逐渐滴加NaOH溶液,有白色沉淀析出,然后又逐渐溶解;Al3++3OH-=Al(OH)3↓;
Al(OH)3+OH-=[Al(OH)4]-
本题解析:
本题难度:一般
3、选择题 下列各组物质性质的比较中,不正确的是?
A.热稳定性:SiH4
C.碱性:NaOH > Mg(OH)2> Al(OH)3
D.金属性:Na > Mg > Al
参考答案:B
本题解析:答案:B
A、正确,Si 、P为同一周期,P、O为同一主族 ;B 、不正确,酸性:H3PO4〈H2SO4〈HClO4
C正确,Na到 Mg金属性减弱, Mg到Na碱性减弱,:?NaOH > Mg(OH)2> Al(OH)3?D.正确,同一周期从左到右,金属性减弱,金属性:Na > Mg > Al
本题难度:简单
4、选择题 下列元素中非金属性最强的是( )
A.C
B.N
C.F
D.O
参考答案:C、N、O、F位于周期表同一周期,且原子序数依次增大,同周期元素从左到右元素的非金属性逐渐增强,所以非金属性最强的是F,
故选C.
本题解析:
本题难度:简单
5、推断题 已知:①A、B、C、D四种物质均含有元素X,可能还含有元素Y或Z。元素Y、X、Z的原子序数依次递增且不超过20。② X在A、B、C、D中的化合价分别为0、-1、+1、+5。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D在二氧化锰催化下受热分解,可制得元素Y的单质。
请回答下列问题:
(1)写出元素X、Y、Z的元素符号:X:_______,Y:_______,Z:_______。
(2)写出A、B、C、D的化学式:A_______,B_______,C_______,D_______。
(3)画出Y原子的结构示意图_______;写出③中反应的化学方程式_____________________。
(4)写出④中反应的化学方程式_____________________。实验室通过反应④制得元素Y的单质后,如何将产物分离并分别获得纯净物?写出实验步骤:__________________________________________
(5)制得元素Y的单质,若收集到标准状况下6.72LY单质气体,至少需要多少克化合物D?同时生成氯化物的物质的量为多少mol?(用涉及到的化学式写出计算步骤)
参考答案:(1)O;Cl;K
(2)A:Cl2;B:KCl;C:KClO;D:KClO3
(3)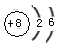 ;Cl2+2KOH==KCl+KClO+H2O
;Cl2+2KOH==KCl+KClO+H2O
(4)“略”
(5)“略”
本题解析:
本题难度:一般