时间:2017-07-18 00:53:23
1、简答题 X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
请回答:
(1)X的电子式______;若实验室用如图所示装置制取X,则制取X的化学反应方程式为______.
(2)已知:W+X+H2O一白色沉淀,为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中,______.
(3)常温下,取10mL?pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化如图所示,则Y的化学式为______,下列叙述正确的是______(选填字母).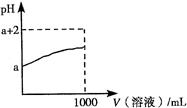
a.Y的水溶液可用作刻蚀玻璃
b.相同温度时与相同浓度的盐酸比较,Y的水溶液的导电能力弱
c.稀释后,阴离子的物质的量浓度之和增大
(4)分子Z中所含元素对应的单质A及A与B形成的化合物可进行如下转化: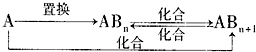
当n=1时,请写出A-ABn的化学方程式______(写出一个即可).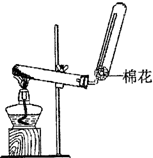
参考答案:(1)常见的含有10电子的分子有:He、HF、H2O、NH3、CH4,X、Y为含有10电子的分子,且X与Z分子中含有的共用电子对数之比为3:4,所以X为NH3,Y为CH4,X的电子式为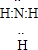
;图中反应装置为固固加热装置,用按盐和碱共热制取氨气,常见的为氯化铵和氢氧化钙反应制取氨气,反应的化学方程式为Ca(OH)2+2NH4Cl?△?.?CaCl2+2NH3↑+2H2O;
(2)W为10电子离子,W+X+H2O一白色沉淀,该白色沉淀可能为Mg(OH)2或Al(OH)3,根据Al(OH)3为两性氢氧化物设计实验,加入足量的氢氧化钠溶液,若观察到白色沉淀溶解,则证明沉淀为Al(OH)3,W为Al3+;若观察到白色沉淀不溶解,则证明白色沉淀为Mg(OH)2,W为Mg2+;
(3)若Y为强酸,加水稀释100倍时,pH为a+2,而Y加水稀释100倍时,pH小于a+2,且Y是含有10电子的分子,则Y为弱酸HF;
a、HF的水溶液为氢氟酸,氢氟酸具有强腐蚀性,能刻蚀玻璃,故a正确;
b、盐酸为强电解质,完全电离,氢氟酸为弱电解质,部分电离,相同温度时与相同浓度的盐酸比较,Y的水溶液离子浓度小,的导电能力弱,故b正确;
c、氢氟酸为弱电解质,稀释后,平衡向电离方向移动,但阴离子的物质的量浓度之和减小;
(4)由以上分析可知,分子Z为CH4,它对应的单质碳可发生题中转化,若n=1,则ABn为一氧化碳,碳和水蒸气或碳与二氧化硅在高温下可发生置换反应生成一氧化碳,反应的化学方程式为:
(4)C+H2?高温?.?CO+H2或2C+SiO2?高温?.?Si+2CO.
故答案为:(1)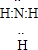
,Ca(OH)2+2NH4Cl?△?.?CaCl2+2NH3↑+2H2O;
(2)加入足量的氢氧化钠溶液,若观察到白色沉淀溶解,则证明W为Al3+;若观察到白色沉淀不溶解,则证明W为Mg2+;
(3)HF,a、b;
(4)C+H2?高温?.?CO+H2(或2C+SiO2?高温?.?Si+2CO).
本题解析:
本题难度:一般
2、选择题 X、Y为短周期元素,X位于ⅠA族,X与Y可形成化合物X2Y,下列说法正确的是
[? ]
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1∶1
D.X2Y可能是离子化合物,也可能是共价化合物
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列关于化学键、离子化合物、共价化合物的叙述中,错误的是
[? ]
A.离子化合物中可能含有共价键
B.共价化合物中可能含有离子键
C.离子化合物中只含离子键
D.共价化合物中不含有离子键
参考答案:BC
本题解析:
本题难度:简单
4、填空题 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素原子的价层电子总数是内层电子总数的2倍;D元素原子的L电子层中只有两对成对电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1) E元素基态原子的核外价层电子排布式为_________。
(2)用元素符号表示B、C、D三种元素的第一电离能由低到高的排序_________。
(3) A元素与B、C元素可形成化合物B2A4、C2A4。
①B2A4的结构式为_________。
②下列有关C2A4的说法正确的是_________。
a.一个该分子中含有4个σ键
b.该分子可作为配位体形成配位键
c.该分子是非极性分子? d.1mol该分子最多可形成4mol氢键
e.该分子的稳定性与氢键无关
f.该分子中C的原子轨道是sp3杂化
(4)B单质的一种的晶体结构如图甲所示,E单质的一种的晶体结构如图乙所示。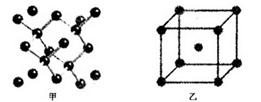
则图中的单质B的名称_________,图甲中B原子的配位数与图乙中E原子的配位数之_________。
E元素与D元素形成的ED晶体与NaCl晶体一样,欲比较ED与NaCl的晶格能大小,需考虑的数据是_______________________________________________________________________________。
(5)据最新资料显示,F单质的晶胞可能有多种,若其晶胞分别以六方紧密堆积和面心立方堆积存在时,其单质的密度之比为_________。
参考答案:(每空2分,第(4)第1空1分,共计15分)(1)3d64s2(2)B<D<C
(3)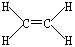 ?② b、e、f(全对2分,选对1~2个得1分,选错一个均不得分)
?② b、e、f(全对2分,选对1~2个得1分,选错一个均不得分)
(4)金刚石;1:2 ;离子的半径与离子所带的电荷
(5)3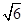 :8
:8
本题解析:B元素原子的价层电子总数是内层电子总数的2倍,所以B是碳元素。D元素原子的L电子层中只有两对成对电子,因此D是氧元素。C的原子序数介于B和D中间,则C是氮元素。E元素的基态原子有4个未成对电子,这说明E应该是第四周期元素,可能是Cr或Fe。E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,所以E只能是Fe,F是Cu。
(1)铁的原子序数是26,根据构造原理可知,其价电子排布式为3d64s2。
(2)B为碳元素,C为氮元素,D为氧元素,同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以B、C、D三种元素的第一电离能数值由小到大的顺序为C<O<N。
(3)A元素与B、C元素可形成化合物B2A4、C2A4,这说明A应该是氢元素。
①B2A4是乙烯,其的结构式为 。
。
②C2A4的结构式是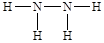 ,所以a. 一个该分子中含有5个σ键,a不正确;b.该分子中氮元素含有孤对电子,所以可作为配位体形成配位键,b周期;c.该分子不对称,是极性分子,c不正确;d.由于氮元素可以形成氢键,所以平均1个N2H4分子可以形成6÷2=3个氢键,因此1mol该分子最多可形成3mol氢键,d不正确;e.氢键不是化学键,不影响物质的稳定性,即该分子的稳定性与氢键无关,e正确;f.该分子中N原子的原子轨道是sp3杂化,f正确,答案选bef。
,所以a. 一个该分子中含有5个σ键,a不正确;b.该分子中氮元素含有孤对电子,所以可作为配位体形成配位键,b周期;c.该分子不对称,是极性分子,c不正确;d.由于氮元素可以形成氢键,所以平均1个N2H4分子可以形成6÷2=3个氢键,因此1mol该分子最多可形成3mol氢键,d不正确;e.氢键不是化学键,不影响物质的稳定性,即该分子的稳定性与氢键无关,e正确;f.该分子中N原子的原子轨道是sp3杂化,f正确,答案选bef。
(4)根据晶胞的几个可知,甲是金刚石。根据晶胞结构可知,金刚石中配位数是4,而铁是体心立方堆积,配位数是8,所以甲中B原子的配位数与图乙中E原子的配位数之1:2;E元素与D元素形成的ED晶体与NaCl晶体一样,都是离子晶体,所以欲比较ED与NaCl的晶格能大小,应该比较晶格能大小,即需要考虑的数据是离子的半径与离子所带的电荷。
(5)体心立方晶胞中铜原子个数=1+8×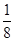 =2;面心立方晶胞中实际含有的铜原子个数=6×
=2;面心立方晶胞中实际含有的铜原子个数=6×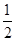 +8×
+8×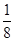 =4。设铜原子半径是a,六方紧密堆积和面心立方堆积的边长分别为x和y,则x2+2x2=(4a)2、y2+y2=(4a)2,解得x=
=4。设铜原子半径是a,六方紧密堆积和面心立方堆积的边长分别为x和y,则x2+2x2=(4a)2、y2+y2=(4a)2,解得x=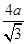 、y=
、y=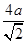 ,所以根据
,所以根据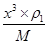 ×NA=2、
×NA=2、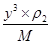 ×NA=4可知,二者的密度之比ρ1:ρ2=3
×NA=4可知,二者的密度之比ρ1:ρ2=3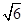 :8。
:8。
本题难度:一般
5、选择题 关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键
B.冰和水中都存在氢键
C.DNA双螺旋的两个螺旋链不是通过氢键相互结合的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
参考答案:B
本题解析:水分子内不存在氢键,A不正确;DNA双螺旋的两个螺旋链是通过氢键相互结合的,C不正确;水分子的稳定性和化学键有关系,与氢键无关,D不正确,答案选B。
点评:该题是基础性试题的考查,也是高考中的常见考点之一。试题主要是考查学生对氢键概念的了解掌握程度,以及灵活运用氢键解决实际问题的能力,难度不大。该题有利于培养学生的逻辑思维能力和发散思维能力。
本题难度:一般