时间:2017-07-18 00:48:36
1、选择题 下列叙述中,不正确的是
A.元素最高化合价:Na
C.酸性:H3PO4
参考答案:B
本题解析:元素周期律的相关知识考查
本题难度:一般
2、选择题 根据相关的化学原理,下列判断正确的是
[? ]
A.由于水中存在氢键,所以稳定性:H2O>H2S
B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2
C.若A2+ 2D-= 2A-+ D2,则氧化性D2>A2
D.若R2-和M+的电子层结构相同,则离子半径R2->M+
参考答案:D
本题解析:
本题难度:简单
3、选择题 A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A;C和D两种元素对应的气态氢化物的稳定性C>D,E是这五种元素中原子半径最小的,则它们的原子序数由小到大的顺序为
[? ]
A.B<A<C<D<E?
B.A<E<B<C<D
C.E<B<A<C<D?
D.B<A<D<C<E
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列说法中正确的是
[? ]
参考答案:A
本题解析:
本题难度:简单
5、推断题 A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,B与C的单质在加热条件下反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)写元素符号:A为_________,B为_________,C为_________。D的最高价氧化物的水化物化学式是
_________。
(2)写出A、B形成的化合物与E反应的化学方程式:___________________________。
(3)E属_________(“离子”或“共价”)化合物。E中含_________键.
(4)C与D两元素可形成化合物,用电子式表示其化合物的形成过程___________________________。
参考答案:(1)C;O;Na;H2SO4
(2)2CO2+2Na2O2==2Na2CO3+O2↑
(3)离子;离子键、共价键
(4)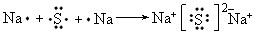
本题解析:
本题难度:一般