时间:2017-07-18 00:38:16
1、选择题 25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量。下列表示该反应的热化学方程式中正确的是( )
A.CH3OH(l)+3/2O2(g) = CO2(g) +2H2O(l) △H=-725.8 kJ·mol-1
B.2 CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(l) △H="+1451.6" kJ·mol-1
C.2 CH3OH+O2 = 2CO2+4H2O△H=-22.68 kJ·mol-1
D.CH3OH(l)+3/2O2(g) = CO2(g)+2H2O(g)△H=-725.8 kJ·mol-1
参考答案:A
本题解析:A、1mol甲醇的质量是32g,则1mol甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ×32=725.76kJ热量,所以1mol甲醇完全燃烧的热化学方程式为CH3OH(l)+3/2O2(g) = CO2(g) +2H2O(l) △H=-725.8 kJ·mol-1,正确;B、由A可知2mol甲醇完全燃烧生成CO2和液态H2O,应该放出热量,△H<0,错误;C、化学方程式中未注明物质的聚集状态,且热效应数值不正确,错误;D、1mol甲醇完全燃烧生成二氧化碳气体和液态水放出725.8kJ的热量,不是水蒸气,错误,答案选A。
考点:考查热化学方程式的书写的判断
本题难度:一般
2、填空题 Na3N是一种重要的化合物,是由______键形成的,其中两种粒子的半径关系是:Na+______N3-(填“>”、“=”或“<”).
参考答案:氮化钠是离子晶体,由钠离子和氮离子构成,所以钠离子和氮离子之间存在离子键,钠离子和氮离子的电子层结构相同,且钠离子原子序数大于氮离子,所以离子半径为钠离子<氮离子,故答案为:离子;<.
本题解析:
本题难度:一般
3、选择题 某溶液可能含有大量CO32-、S2-、SO32-、SO42-、NO3-、NO2-、OH-等阴离子.为检测上述阴离子,某研究性小组设计了下列实验:
①取少量吸收液于试管中,加入过量的稀盐酸,产生淡黄色浑浊和气体,将所得的气体依次通入品红溶液、足量酸性KMnO4溶液和澄清石灰水,品红褪色,石灰水变浑浊.
②另取少量待测液于试管中,加入过量的KClO3固体、AgNO3和稀硝酸,有白色沉淀产生.
③另取少量待测液于试管中,酸化后再加入淀粉KI溶液,呈蓝色.
④另取少量待测液于试管中,加入足量的BaCl2溶液和稀盐酸,有白色沉淀产生.
下列说法正确的是
A.由①可推测溶液中一定含大量CO32-、S2-、SO32-、NO3-
B.由②可推测溶液中一定含大量NO2-
C.由③可推测溶液中一定含大量NO3-
D.由实验④难以推测溶液中一定含大量SO42-
参考答案:D
本题解析:分析:①取少量吸收液于试管中,加入过量的稀盐酸,产生淡黄色浑浊和气体,该黄色沉淀只能是S,将所得的气体依次通入品红溶液、品红褪色,气体含有SO2,通过足量酸性KMnO4溶液,除去SO2,再通过澄清石灰水,石灰水变浑浊,则气体为CO2,故原溶液含有CO32-、S2-、SO32-,酸性条件下S2-、SO32-反应生成S与SO2,不能说明溶液中含有氧化性的离子;
②另取少量待测液于试管中,加入过量的KClO3固体、AgNO3和稀硝酸,有白色沉淀产生,该白色沉淀为AgCl,说明原溶液中含有还原性微粒,据此结合离子的性质分析判断;
③另取少量待测液于试管中,酸化后再加入淀粉KI溶液,呈蓝色,说明有碘单质生成,故原溶液中含有酸性条件有强氧化性的微粒;
④另取少量待测液于试管中,加入足量的BaCl2溶液和稀盐酸,有白色沉淀产生,该白色沉淀为BaSO4,由于溶液中含有SO32-及酸性条件下有氧化性微粒,不能说明原溶液中含有SO42-.
解答:A.取少量吸收液于试管中,加入过量的稀盐酸,产生淡黄色浑浊和气体,该黄色沉淀只能是S,将所得的气体依次通入品红溶液、品红褪色,气体含有SO2,通过足量酸性KMnO4溶液,除去SO2,再通过澄清石灰水,石灰水变浑浊,则气体为CO2,故原溶液含有CO32-、S2-、SO32-,酸性条件下S2-、SO32-反应生成S与SO2,不能说明溶液中含有NO3-、NO2-,故A错误;
B.另取少量待测液于试管中,加入过量的KClO3固体、AgNO3和稀硝酸,有白色沉淀产生,该白色沉淀为AgCl,说明原溶液中含有还原性微粒,由于原溶液有S2-、SO32-,不能说明溶液中含有NO2-,故B错误;
C.另取少量待测液于试管中,酸化后再加入淀粉KI溶液,呈蓝色,说明有碘单质生成,故原溶液中含有酸性条件有强氧化性的微粒,故原溶液中可能含有NO3-、NO2- 中的至少1种,故C正确;
D.另取少量待测液于试管中,加入足量的BaCl2溶液和稀盐酸,有白色沉淀产生,该白色沉淀为BaSO4,由于溶液中含有SO32-及酸性条件下有氧化性微粒,可以将SO32-氧化为SO42-,不能说明原溶液中含有SO42-,故D正确;
故选D.
点评:本题考查离子检验与推断,注意干扰离子的影响,掌握离子之间发生的反应与现象是关键,难度中等.
本题难度:困难
4、选择题 下列热化学方程式书写正确的是(?)
A.2SO2+O2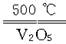 2SO3ΔH="-196.6" kJ·mol-1
2SO3ΔH="-196.6" kJ·mol-1
B.H2(g)+ O2(g)====H2O(l)ΔH="-285.8" kJ·mol-1
O2(g)====H2O(l)ΔH="-285.8" kJ·mol-1
C.2H2(g)+O2(g)====2H2O(l) ΔH="-571.6" kJ
D.C(s)+O2(g)====CO2(g)ΔH="+393.5" kJ·mol-1
参考答案:B
本题解析:根据热化学方程式的书写规则,反应热单位为kJ·mol-1。
本题难度:简单
5、选择题 下列说法或表示方法正确的是
A.在稀溶液中,H+(aq)+ OH—(aq)= H2O(l)△H =-57.3 kJ·mol—1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
B.由C(石墨)= C(金刚石)△H =" +1.90" kJ/mol可知金刚石比石墨稳定
C.相同温度下,①pH=5的NH4Cl溶液、② pH=4的稀盐酸中由水电离出的c (H+):①<②
D.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+) > c(CH3COO—)
参考答案:A
本题解析:A选项浓硫酸溶于水会放热,故反应放出的热大于57.3 kJ。B选项金刚石比石墨稳定是由它们的结构决定的。C选项NH4Cl在水溶液中会发生水解促进水的电离,而在稀盐酸溶液中,氢离子浓度大,会抑制水的电离,故由水电离出来的c (H+):①>②。D选项由电荷守恒可得:c(Na+)+ c (H+)= c(CH3COO—)+c(OH—),溶液的PH=5.6,c(OH—)<c (H+),故c(Na+) <c(CH3COO—)。
考点:中和热、溶液中离子浓度的比较,物质稳定性的比较。
点评:本题A、B选项涉及到了中和热的定义和物质能量的比较,物质能量越高,越不稳定,后两个选项涉及弱电解质的电离中,离子浓度的比较,注意使用电荷守恒,物料守恒来比较。
本题难度:一般