时间:2017-07-18 00:36:48
1、选择题 下图各装置中,电解质溶液均为硫酸铜溶液,其中一定不能构成原电池的是( )
A.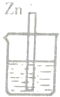
B.
C.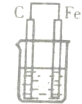
D.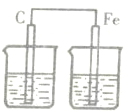
参考答案:题中B、C都符合原电池的构成条件,所以能构成原电池,而A中锌先置换出铜,然后可形成原电池反应,但D没有形成闭合回路,则不能形成原电池.
故选D.
本题解析:
本题难度:简单
2、选择题 由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的酸性( )
A.不变
B.逐渐减弱
C.逐渐增强
D.先减弱,后增强
参考答案:铜、锌和稀硫酸组成的原电池工作时的电池反应为:Zn+2H+=H2↑+Zn2+,消耗氢离子,所以电解质溶液的酸性减弱.
故选B.
本题解析:
本题难度:一般
3、选择题 根据右图装置判断下列说法错误的是(?)
A.铜片上有气泡产生
B.铜片上发生氧化反应
C.锌片为负极
D.该装置将化学能转化为电能
参考答案:B
本题解析:此装置为铜锌原电池装置。将化学能转化为电能,其中锌为负极:Zn- 2e=Zn2+,发生氧化反应;铜为正极:2H+ +2e=H2,发生还原反应。故答案为B 。
点评:本题考查了原电池原理,难度不大,注意从氧化还原反应的电子得失来判断原电池电极反应式的书写。
本题难度:一般
4、填空题 (9分) (1)下列反应能设计成化学能转化为电能的装置是
A Zn+CuSO4=ZnSO4+Cu B NaOH+HCl=NaCl+H2O
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极和电解质溶液,并写出电极反应式:
正极反应 负极反应 .
(3)某烷烃的蒸气质量是相同条件下氢气质量的36倍,该烃的分子式为____________,请写出该烃同分异构体中有4种不同沸点的一氯代物的该烃的结构简式,并命名:
、
参考答案:(1) A (1分)
(2) Cu2++2e-=Cu (1分)Zn-2e-=Zn2+ (1分)(正极材料只要合理均可)(2分)
(3)C5H12 (1分) (1分) 2-甲基丁烷(或异戊烷)(1分)
本题解析:(1)因为电子的定向移动才能形成电流,所以只有氧化还原反应才能设计成原电池,即选项A正确。
(2)根据反应式可知,锌是还原剂,失去电子,作负极。铜离子得到电子,在正极得到电子析出。电极反应式分别为负极反应: Zn-2e-=Zn2+、正极反应:Cu2++2e-=Cu。装置图如图所示: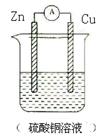
(3)气体的密度之比是相应的相对分子质量之比,所以烷烃的相对分子质量是36×2=72。所以根据烷烃的通式CnH2n+2可知,分子式为C5H12。戊烷有3种同分异构体,其中正戊烷有3种氢原子、异戊烷有4种氢原子,新戊烷有1种。
本题难度:一般
5、选择题 钛被称为21世纪金属。研究发现,用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图所示装置制备金属钛。下列叙述正确的是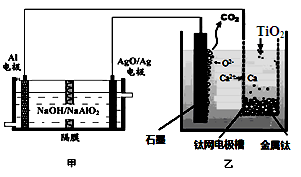
A.乙装置阴极的电极反应式为
TiO2+4e-=Ti+2O2-
B.若不考虑能量的损失,制备24.0g
金属钛,需要消耗金属铝36.0g
C.甲装置工作过程中OH-向AgO/Ag极移动;乙装置工作过程中O2-向钛网移动
D.乙装置中的石墨电极需要定期更换
参考答案:D
本题解析:根据题给装置知,甲池为原电池,Al电极为负极,被氧化,AgO/Ag电极为正极,发生还原反应,乙为电解装置,阳极上电极反应式为C+2O2--4e-═CO2↑,阴极上电极反应式为:2Ca2++4e-═2Ca,钙与二氧化钛发生反应:2Ca+TiO2=Ti+2CaO。A、乙装置阴极的电极反应式为2Ca2++4e-═2Ca、2Ca+TiO2=Ti+2CaO,错误;B、n(Ti)=0.5mol,则消耗1molCa,转移2mol电子,由电极方程式Al+4OH---3e-═AlO2-+2H2O可知,需要2/3molAl,质量为18g,错误;C、甲装置工作过程中OH-向负极移动,即向Al极移动,错误;D、因乙装置中的石墨电极不断被消耗,则乙装置中的石墨电极需要定期更换,正确。
本题难度:一般