时间:2017-07-18 00:32:44
1、简答题 Ⅰ:元素的金属活动性递变规律是元素周期表学习的重要内容之一.某校研究性学习小组查阅课外资料,看到第IVA族的三种金属锗、锡、铅的性质:“锗、锡在空气中不反应,铅在空气中表面生成一层氧化铅,请解释发生上述变化的原因是______.
Ⅱ:另一研究性学习小组欲通过实验探究Zn、Fe、Cu的金属活动性顺序,根据不同的实验条件设计了如下的几种实验方案:
(1)该小组同学根据提供的Zn片、Fe片和稀硫酸,设计成了一个原电池比较锌与铁的活动性顺序,请在右侧方框内画出原电池装置图.
并写出正极的反应现象及电极反应式.
现象______;电极反应式______.
(2)现只有Fe片、CuO和稀硫酸这几种药品,请你帮忙设计方案比较铁与铜的活动性顺序.你的设计方法是______.
2、选择题 下列各组元素属于p区的是?
[? ]
A.原子序数为1、2、7的元素 ?
B.O、S、P ?
C.Fe、Ar、Cl ?
D.Na、Li、Mg
3、选择题 运用元素周期律分析下面的推断,其中错误的是
A.铍的氧化物的水化物可能具有两性
B.硫酸锶是难溶于水的白色固体
C.砹为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于稀酸
D.硒化氢是无色、有毒、比硫化氢稳定的气体
4、选择题 下列各图为元素周期表的一部分,表中的数字为原子序数,其中M为37的是
[? ]
A.
B.
C.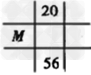
D.
5、选择题 下列各组大小顺序不正确的是
A.酸性:H2SiO3<H3PO4<H2SO4<HClO4
B.热稳定性:SiH4<PH4<H2S<HCl
C.金属的还原性:Na<Mg<Al
D.还原性:HF<HCl<HBr<HI