时间:2017-07-18 00:22:05
1、选择题 图所示的实验装置或操作不能达到实验目的是( )
A.①
B.②
C.③
D.④
2、选择题
下列有关叙述正确的是( )
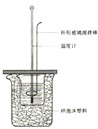
3、实验题 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是_________________________________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”.“偏小’.“无影响”)
(3) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是____________________________________________________;所求中和热的数值会________(填“相等”或 “不相等”),理由是________________________________________________________。
4、选择题 下列有关实验问题叙述正确的是( )
A.测定中和热时,用环形铜质搅拌棒搅拌溶液,使测得的温度更准确
B.利用烧杯、玻璃棒、量筒、容量瓶就可以配制2mol/L的硫酸溶液
C.用pH计测得某次雨水的pH为3.7
D.用标准浓度HCl滴定未知浓度NaOH溶液,中和滴定曲线如图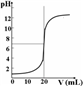
5、填空题 分别取4大mL的大?了大mol/L盐酸与4大mL?大.了了mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
(o)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、______、______.
(得)为什么中和热测定中要用稍过量的碱(或酸):______
(3)假设盐酸和氢氧化钠溶液的密度都是og/左m3,又知中和后生成溶液的比热容左=4?o8J/(g?℃).为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=______;?(结果保留一位小数)
(4)上述实验数值结果与中和热的理论值了7.34J/mol有偏差,产生偏差的原因可能是(填字母)______.
a.实验装置保温、隔热效果差?b.量取盐酸与氢氧化钠溶液时仰视读数左.分多次把Na大H溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度.