时间:2017-07-18 00:19:31
1、选择题 对于反应KMnO4+HCl-KC1+MnCl2+Cl2+H2O(未配平),若有0.1mol?KMnO4?参加反应,下列说法不正确的是
A.转移0.5?mol电子
B.氧化产物与还原产物之比为5:2
C.参加反应的HC1为0.8?mol
D.氧化剂与还原剂之比为1:8
参考答案:D
本题解析:分析:根据氧化还原反应中氧化剂和还原剂得失电子数目相等可知反应的方程式为2KMnO4+16HCl=2KC1+2MnCl2+5Cl2+8H2O,根据元素化合价的变化判断氧化剂和还原剂以及电子转移的数目.
解答:配平后的反应的方程式为2KMnO4+16HCl=2KC1+2MnCl2+5Cl2+8H2O,若有0.1molKMnO4?参加反应,则
A.转移电子的物质的量为0.1mol×(7-2)=0.5mol,故A正确;
B.氧化产物为Cl2,还原产物为MnCl2,物质的量之比为5:2,故B正确;
C.由方程式可知,若有0.1molKMnO4?参加反应,应有0.8molHCl参加反应,故C正确;
D.若有0.1molKMnO4?参加反应,有0.8molHCl参加反应,其中有0.5molHCl被氧化,氧化剂与还原剂之比为1:5,故D错误.
故选D.
点评:本题考查氧化还原反应,题目难度中等,先配平反应的化 学方程式为解答该题的关键,注意氧化剂和还原剂等概念的判断.
本题难度:困难
2、选择题 下列有机物中可能含有酯基的是
A.CH2O2
B.C2H4O
C.C3H6O3
D.C4H10O4
参考答案:C
本题解析:酯基的结构简式为-COO-,所以分子中要含有酯基,至少含有2个氧原子,B不正确。A是甲酸,不正确。D中含有4个碳原子和10个氢原子,因此碳原子全部是饱和碳原子,不可能含有酯基。根据C的分子式可知,其结构简式可以是HOCH2COOCH3,所以正确的答案是C。
本题难度:一般
3、选择题 美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁·沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖。经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的是
A.该有机物属于芳香烃
B.1mol该有机物分子中含有7mol碳碳双键
C.该有机物与溴水既能发生加成反应,又能发生取代反应
D.该有机物所有原子都有可能共平面
参考答案:C
本题解析:试题分析:该分子中除了C、H元素外还有N、O元素,不属于芳香烃,A错误;苯环不是单双键交替结构,1mol该有机物只有1mol碳碳双键,B错误;该有机物中碳碳双键能与溴水加成,酚羟基邻位上的氢可以被Br取代,C正确;联想CH4结构,该分子中含亚甲基和次甲基结构,所有原子不可能共面,联想NH3的空间构型,分子中含-NH-结构,所有原子也不可能共面,D错误。
考点:有机物的组成与性质
点评:分子有甲基,所有原子不可能共面。
本题难度:简单
4、选择题 某有机物CxHmOn完全燃烧时需要氧气的物质的量是该有机物的x倍,则其化学式中x、m、n的关系不可能的是
A.m>2x+2
B.m=2x+2
C.x︰m︰n=1︰2︰1
D.m︰n=2︰1
参考答案:A
本题解析:由燃烧通式可知,1mol CxHmOn完全燃烧需要的氧气的物质的量为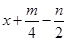 ,故由题意知
,故由题意知=x,即m=2n(或者说有机物可书写为Cx(H2O)y的形式),结合题意,则后三选项均有可能,但A项是绝对不可能的,在有机物分子中,H原子数最多是C原子个数的两倍多2,所以答案为A
本题难度:一般
5、选择题 下列不能通过单质间反应而制得的物质是
A.CuCl2
B.CuS
C.FeCl3
D.FeS
参考答案:B
本题解析:分析:A.CuCl2可由Cu在Cl2中燃烧生成;
B.硫与铜反应生成硫化亚铜;
C.铁和氯气反应生成三氯化铁;
D.铁和硫加热反应生成硫化亚铁.
解答:A.Cu在Cl2中燃烧生成CuCl2,Cu+Cl2 CuCl2,单质间反应能生成,故A正确;
CuCl2,单质间反应能生成,故A正确;
B.硫的氧化性弱,只能将金属氧化成低价态,铜与硫反应生成硫化亚铜,铜为-1价,2Cu+S Cu2S,单质间反应不能生成,故B错误;
Cu2S,单质间反应不能生成,故B错误;
C.铁和氯气反应生成三氯化铁2Fe+3Cl2 2FeCl3,单质间反应能生成,故C正确;
2FeCl3,单质间反应能生成,故C正确;
D.铁和硫加热反应生成硫化亚铁Fe+S FeS,单质间反应能生成,故D正确;
FeS,单质间反应能生成,故D正确;
故选B.
点评:本题考查了元素化合物的性质,熟悉相关的化学反应的方程式是解答的关键,注意物质的特征反应和基础知识的积累,题目较简单.
本题难度:简单