时间:2017-07-18 00:15:51
1、填空题 ①Cu、②NaOH、③I2、④MgCl2、⑤Na2O2、⑥Ar,回答下列问题。
(1)不存在化学键的是_________;
(2)存在金属键的是_________;
(3)只存在非极性键的是_________;
(4)只存在离子键的是_______;
(5)既存在离子键又存在极性键的是________;
(6)既存在离子键又存在非极性键的是________。
参考答案:(1)⑥
(2)①
(3)③
(4)④
(5)②
(6)⑤
本题解析:
本题难度:一般
2、选择题 下列表达方式错误的是(
A.CO2分子的比例模型
B.甲烷的电子式?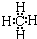
C.硫离子的核外电子排布式1s22s22p63s23p4
D.HClO的结构式:H-O-Cl
参考答案:C
本题解析:
本题难度:简单
3、填空题 根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有________种;写出Cu+的核外电子排布式________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有________种,属于d区的元素有________种。
(3)CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为________;CaO的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是________________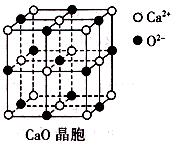
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是________(填选项字母)。
A.NaN3与KN3结构类似,前者晶格能较小
B.晶体钾的晶胞结构如图所示: ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为_______,CNO-的中心原子的杂化方式为_______
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。
参考答案:
(1)3 ?1s22s22p63s23p63d10?
(2)2 ? 8
(3)6 激发态的电子从能量高的轨道跃迁到能量较低的轨道时,以一定波长光的形式释放能量。
(4)B C?
(5)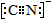 ?sp杂化?
?sp杂化?
(6)[CrCl(H2O)5]2+
本题解析:(1)第四周期中基态原子核外电子排布中4s轨道上只有1个电子的元素有K、Cr、Cu三种。Cu失去4s轨道上一个电子形成的Cu+核外电子排布为1s22s22p63s23p63d10。
(2)第四周期属于s区的元素是K、Ca两种。属于d区的元素是第IIIB族到第VIIB族及第VIII族,第四周期共有8种元素。
(3)根据晶胞结构示意图,可知Ca2+周围距Ca2+最近的O2-有6个,因此Ca2+的配位数为6。金属元素会有焰色反应,是因为激发态的电子从能量高的轨道跃迁到能量较低的轨道时,以一定波长光的形式释放能量。
(4)Na+半径小于K+半径,离子所带电荷相同时,半径越小晶格能越大,因此NaN3的晶格能高于KN3的晶格能,A错;K晶体为体心立方,每个晶胞中含有2个K原子,B正确;N原子的2p轨道半满,不容易失去电子,因此第一电离能N>O,C正确;氮气常温下稳定,因为氮气分子中含有氮氮三键,D错。
(5)CN-与N2是等电子体,因此电子式相似。CNO-与CO2是等电子体,因此中心原子杂化方式相同,是sp杂化。
(6)生成的H+的物质的量为:n(H+)=n(NaOH)=0.1200×25.00×10-3mol=0.003mol,根据方程式,可计算得出x=2。在配离子中,Cr +3价,根据化合价计算规则,可知n=1,则配离子为[CrCl(H2O)5]2+。
本题难度:困难
4、选择题 六氟化硫分子呈正八面体,难以水解,在高电压下仍有良好的绝缘性,在电器工业有着广泛用途,但逸散到空气中会引起强温室效应。下列有关SF6的推测正确的是(?)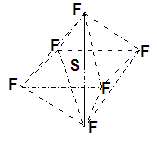
A.SF6易燃烧生成SO2
B.SF6是极性分子
C.SF6中各原子均达到八电子稳定结构
D.高温条件下,SF6微弱水解生成H2SO4和HF
参考答案:D
本题解析:六氟化硫分子呈正八面体,所以是非极性分子,B不正确;在高电压下仍有良好的绝缘性,说明不易燃烧,A不正确;由于S原子的化合价是+6价,而最外层电子数是6个,所以不能是8电子稳定结构,C不正确,所以正确的答案选D。
本题难度:一般
5、选择题 氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如邻羟基苯甲醛分子( ) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子( HO
) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子( HO CHO )之间存在氢键(分子间氢键)。则两者的熔点、沸点的相对大小关系是(?)
CHO )之间存在氢键(分子间氢键)。则两者的熔点、沸点的相对大小关系是(?)
A.前者>后者
B.前者<后者
C.前者=后者
D.无法估计
参考答案:B
本题解析:由于分子间氢键强于分子内的氢键,所以邻羟基苯甲醛的熔沸点小于对羟基苯甲醛熔沸点,答案选B。
点评:该题是常识性知识的考查,试题基础性强,紧扣教材基础知识,意在调动学生的学习兴趣和学习积极性,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:一般