时间:2017-07-18 00:04:47
1、填空题 (6分)
(1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式
?
(2)铁与高温水蒸气反应:??
(3)碳酸钠与稀盐酸反应:?
参考答案:略
本题解析:略
本题难度:一般
2、选择题 通常用活性炭去除冰箱中的异味,主要利用了活性炭的
[? ]
A.吸附性
B.还原性
C.稳定性
D.氧化性
参考答案:A
本题解析:
本题难度:简单
3、选择题 X、Y都是IIA(Be除外)的元素,已知它们的碳酸盐的热分解温度:T(XCO3)>T(YCO3),则下列判断正确的是
[? ]
A.晶格能: XCO3>YCO3
B.阳离子半径: X2+>Y2+
C.金属性: X>Y
D.氧化物的熔点: XO>YO
参考答案:AD
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
[? ]
A.化学反应既遵守“质量守恒”定律,也遵守“能量守恒”定律
B.HF、HCl、HBr、HI的的稳定性依次增强
C.丁烷与异丁烷是同系物(homolog)
D.石油裂化(cracking)的目的是使直链烃转化为芳香烃
参考答案:A
本题解析:
本题难度:一般
5、填空题 下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号.请参照元素A~J在周期表中的位置,回答下列问题:
| 纵行 横行 | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 1 A 2 B C D 3 F G H E I J |
参考答案:表格中A为H,B为C,C为N,D为O,E为S,F为Na,G为Al,H为Si,I为Cl,J为Ar.
(1)在元素周期表中同主族从上到下,金属性逐渐增强,非金属性逐渐减弱,同一周期从左到右金属性逐渐减弱,非金属性逐渐增强,故最左下角的F元素Na金属性最强,对应的最高价氧化物对应水化物的碱性最强故为NaOH,非金属性最强的为I,为Cl,其最高价氧化物对应的水化物酸性最强,故酸性最强的为HClO4
故答案为:NaOH; HClO4 ;
(2)J为Ar,为18号元素,故其原子结构示意图为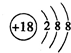
,C为N,位于元素周期表的第二周期,第VA族;
故答案为:
; VA;
(3)N元素的氢化物为氨气,是一种碱性气体,最高价氧化物对应水化物为强酸,两者可发生中和反应,故此元素为N;?
故答案为:N;?
(4)D为O,E为S,F为Na,G为Al,对应的离子为 02-,S2-,Na+,Al3+,其中S2-为18电子构型,其余均为10电子,故S2-半径最大,当核外电子数相同时,离子的核电荷数越大,离子半径越小,核电荷数铝>钠>氧,
故离子半径S2->02->Na+>Al3+;
故答案为:S2->02->Na+>Al3+;
(5)G为Al,电解精炼铝的化学方程式为2Al2O3?电解?.?4Al+302;A为H,D为O,E为S,F为Na,都含有A、F、D、E四种元素的两种盐溶液,可以相互反应,符合条件的是亚硫酸氢钠和硫酸氢钠,亚硫酸氢钠为一种酸式盐,硫酸氢钠可以完全电离出氢离子,可以反应生成二氧化硫和水,反应方程式如下:
NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O
故答案为:2Al2O3?电解?.?4Al+302 NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O;?
(6)B为C,C为N,证明其非金属性强弱可以有很多方法,如对应氢化物的稳定性,最高价氧化物对应水化物的酸性等,其中酸性比较可以用硝酸与碳酸钠反应生成硝酸钠和二氧化碳、水,二氧化碳和水即为碳酸,强酸制取弱酸,故硝酸酸性强,反应方程式为2HNO3+Na2CO3=2NaNO3+H2O+CO2↑
故答案为:2HNO3+Na2CO3=2NaNO3+H2O+CO2↑
(7)G为Al元素既表现金属性又有一定的非金属性,向AlCl3溶液中逐渐滴加NaOH溶液,有白色沉淀析出,说明铝元素具有金属性,然后又逐渐溶解说明其具有非金属性,反应的方程式可以分段书写为:
Al3++3OH-=Al(OH)3↓; Al(OH)3+OH-=[Al(OH)4]-
故答案为:向AlCl3溶液中逐渐滴加NaOH溶液,有白色沉淀析出,然后又逐渐溶解;Al3++3OH-=Al(OH)3↓;
Al(OH)3+OH-=[Al(OH)4]-
本题解析:
本题难度:一般