时间:2017-07-17 23:57:50
1、推断题 现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96gD的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
(1)写出元素符号:A__________,C___________,E____________。
(2)B、D的最高价氧化物对应水化物相互反应的离子方程式为:_________________________。
(3)用电子式表示C与E形成E2C的过程:__________________________。
参考答案:(1)H;S;K
(2)Al(OH)3+OH-==AlO2-+2H2O
(3)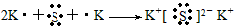
本题解析:
本题难度:一般
2、填空题 有A、B、C、D、E 五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)以上这五种元素中,属于S区的是_____________________________(填元素符号)。
(2)由这五种元素组成的一种化合物是_______________________________(写化学式)。
(3)写出D元素基态原子的最外层电子排布图__________________________________。
(4)元素电负性为B_______D,元素第一电离能为C______E。(填“﹥”、“﹤”或“﹦”)
参考答案:(1)H、K
(2)KAl(SO4)2·12H2O
(3)
(4)>;>。
本题解析:
本题难度:一般
3、填空题 X、Y、Z是IA→ⅦA族的三种非金属元素,它们在周期表中的位置如下表所示
试回答:
(1)X元素单质的化学式是________________。
(2)Y元素的原子结构示意图是_______,Y与Na 所形成化合物的电子式为____________。
(3)Z元素的名称是________,从元素原子得失电子的角度看,Z元素具有_______性;若从Z元素在周期表中所处位置看,它具有这种性质的原因是______________,其价电子排布式为_______。
参考答案:(1)F2
(2) ;
;
(3)砷;两;Z位于元素周期表中金属与非金属交界线附近;4s24p3
本题解析:
本题难度:一般
4、填空题 下表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 1 A 2 D E G I 3 B C F H |
参考答案:(1)根据元素周期表的结构,表中A、B、C、D、E、F、G、H、I元素分别是H、Na、Al、C、N、P、F、Cl、Ne,则其中Na和Al是金属元素,根据同周期元素金属性递变规律可知,金属性最强的应该是Na,即还原性最强的单质是Na;其中H、C、N、P、F、Cl是非金属元素,根据同周期、同主族元素非金属性递变规律可知,非金属性最强的应该是F,即氧化性最强的单质是F2;化学性质最不活泼的应是惰性气体,即Ne.故答案为:Ne;F2;Na;
(2)由(1)分析,金属性最强的是Na,最高价氧化物的水化物碱性最强的是NaOH;非金属性最强的是F,但是F无最高正价,则酸性最强的是应是HClO4.,故答案为:NaOH;HClO4;
(3)E的单质是N2,其结构式是N三N;D元素最高价氧化物是CO2,其电子式为:
,故答案为:N三N;
;?
(4)B与C两元素最高价氧化物的水化物分别是NaOH和Al(OH)3,二者反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
本题解析:
本题难度:简单
5、选择题 短周期元素R的原子核外电子数等于核内中子数,该元素单质7.8g与氧气充分反应可生成13g化合物RO,则该元素的价电子层是
[? ]
A.1s2
B.2s2
C.3s2
D.4s2
参考答案:C
本题解析:
本题难度:一般