时间:2017-07-10 20:37:29
1、选择题 下图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽、接通电路后发现上
为电镀槽、接通电路后发现上 的c点显红色.为实现铁上镀锌,接通
的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是
后,使c、d两点短路.下列叙述正确的是 
[? ]
A.a为直流电源的负极
B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板
D.e极发生还原反应
参考答案:B
本题解析:
本题难度:一般
2、填空题 (19分)
(1)利用H2S废气制取氢气的方法有多种。
①高温热分解法:已知: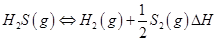 在恒容密闭容器中,控制不同温度进行H2S分解实验。
在恒容密闭容器中,控制不同温度进行H2S分解实验。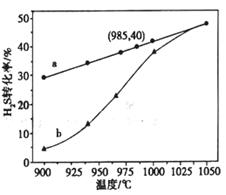
以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。 _____________0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因: _____________________。
_____________0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因: _____________________。
②电化学法
该法制氢过程的示意图如图。反应池中反应的离子方程式是___________________;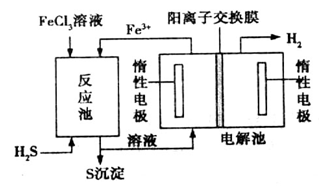
反应后的溶液进入电解池,电解总反应的离子方程式为________________。
(2)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式_______________________________________________。
②电池总反应的化学方程式_________________________________________________。
(3)某亚硝酸钠固体中可能含有碳酸钠和氢氧化钠,现测定亚硝酸钠的含量。
已知:5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
称取4.000g固体,溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L,酸性KmnO4溶液进行滴定,实验所得数据如下表所示;
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
参考答案:(19分)
(1)① >(2分),温度升高,反应速率加快,达到平衡所需的时间缩短(或温度升高,反应速率加快,相同时间内更快达到平衡) (2分)
②2Fe3+ + H2S="=" 2Fe2++S↓+2H+(2分)
2Fe2+ + 2H+ 2Fe3++H2↑(2分)
2Fe3++H2↑(2分)
(2)①Al-3e- + 4OH-=[Al(OH)4]- (或AlO2-+2H2O ) (2分)
②Al+3NiO(OH)+ H2O+ OH-= 3Ni(OH)2+ AlO2-; (2分)
(3)①由无色变为紫红色(2分)
②A C (2分)
③86.25%(3分)
本题解析:(1)①温度升高,反应物的转化率增大,说明升高温度,平衡正向移动,所以△H>0;随温度的升高,曲线b向曲线a靠近,是因为温度升高,反应速率加快,达到平衡的时间缩短;
②反应池中是硫化氢与氯化铁发生的氧化还原反应,生成亚铁离子和S单质及氢离子,离子方程式是2Fe3+ + H2S="=" 2Fe2++S↓+2H+;得到的溶液为氯化亚铁和氯化氢进入电解池,则电解氯化亚铁和氯化氢的混合液得到氢气和氯化铁,所以电解池中发生反应的离子方程式是2Fe2+ + 2H+ 2Fe3++H2↑;
2Fe3++H2↑;
(2)①以Al和NiO(OH)为电极,NaOH溶液为电解液组成的电池中,Al失去电子发生氧化反应,作电池的负极,结合电解质溶液,所以负极的电极反应式为Al-3e- + 4OH-= AlO2-+2H2O;
②正极是NiO(OH)转化为Ni(OH)2,电极反应式是NiO(OH)+ e- + H2O= Ni(OH)2+ OH-,根据得失电子守恒,将正负极的电极反应式相加,所以电池的总反应是Al+3NiO(OH)+ H2O+ OH-= 3Ni(OH)2+ AlO2-;
(3)①滴入最后一滴酸性KMnO4溶液,溶液由无色变为浅红色,30秒内不恢复,可判断达到滴定终点;
②第一组数据偏大,可能是酸式滴定管用蒸馏水洗净后未用标准液润洗,造成高锰酸钾溶液的浓度降低,消耗高锰酸钾溶液的体积偏大;或者是滴定终了仰视读数,使读取数值偏大,锥形瓶未干燥,对结果无影响,所以答案选AC;
③由于第一组数据偏大,故舍去,取后三组数据,消耗高锰酸钾溶液的体积平均为20.00mL,所以亚硝酸钠的质量是20.00×10-3L×0.1000mol/L×5/2×250/25×69g/mol=3.45g,则固体中亚硫酸钠的质量分数是3.45g/4.000g×100%=86.25%。
考点:考查氧化还原反应的分析,化学平衡的判断,滴定终点的判断,误差分析,质量分数的计算
本题难度:困难
3、选择题 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是
A.a为直流电源的负极
B.阴极的电极反应式为:2HSO3-+2H++e-=S2O42-+2H2O
C.阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
参考答案:C
本题解析:A、从反应物和产物化合价判断,左边硫的化合价从+4价到+6价,化合价升高失去电子为阳极,a为正极,错误;B、电子数目不对,电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O,错误;C、正确;D、电解时阳离子向阴极移动,阴离子向阳极移动,错误。
本题难度:一般
4、选择题 把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )
A.1︰2︰3
B.3︰2︰1
C.6︰3︰1
D.6︰3︰2
参考答案:D
本题解析:每生成1mol金属钾、镁、铝转移电子的物质的量是1mol、2mol、3mol。所以根据电子的得失守恒可知,当通过的电子的物质的量相等时,析出钾、镁、铝的物质的量之比为1︰1/2︰1/3=6︰3︰2,答案选D。
点评:在电解的有关计算中,首先是准确判断出离子的放电顺序,写出相应的电极反应式。然后根据电子的得失守恒进行分析和计算即可。
本题难度:一般
5、选择题 若在铜片上镀银时,下列叙述正确的是( )
①将铜片接在电源的正极上?
②将银片接在电源的正极上?
③在铜片上发生的反应是:Ag++e-→Ag?
④在银片上发生的反应是:4OH--4e-→O2↑+2H2O
⑤需用硫酸铜溶液为电镀液 ?
⑥需用硝酸银溶液为电镀液.
A.①③⑥
B.②③⑥
C.①④⑤
D.②③④⑥
参考答案:阳极电镀原理,若在铜片上镀银时,铜做电解池的阴极与电源负极相连,电解质溶液中的银离子得到电子发生还原反应生成银;银做电解池的阳极和电源正极相连,铜失电子发生氧化反应生成铜离子;电解质溶液为硝酸银溶液;
①将铜片应接在电源的负极上,故①错误;
②将银片应接在电源的正极上,故②正确;
③在铜片上发生的反应是:2Ag++2e-→2Ag?故③正确;
④在银片上发生的反应是:2Ag++2e-→2Ag,故④错误;
⑤用硫酸铜溶液为电镀液,阴极析出铜,故⑤错误;
⑥需用硝酸银溶液为电镀液.故⑥正确;
故选B.
本题解析:
本题难度:简单