时间:2017-07-10 20:37:06
1、推断题 短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。请回答下列问题:
(1)组成单质A的元素位于周期表第________周期,第________族。
(2)B与氢氧化钠溶液反应的化学方程式为:________________________。
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为________,当生成2mol二氧化氯时,转移电子________mol。
(4)溶液F在空气中长期放置生成H的化学方程式为:________________________。
(5)H的溶液与稀硫酸反应的现象为________________________。
参考答案:(1)三;ⅥA
(2)2Al+2NaOH+2H2O==2NaAlO2+3H2↑
(3)硫酸钠(Na2SO4);2
(4)4Na2S+O2+2H2O=4NaOH+2Na2S2 (或2Na2S+O2+2H2O==4NaOH+2S、Na2S+S=Na2S2)
(5)溶液由黄色变为无色,产生浅黄色沉淀和臭鸡蛋气味的气体
本题解析:
本题难度:困难
2、填空题 根据周期律对角线规则,金属Be与铝单质及其化合物的性质相似.又知AlCl3熔、沸点较低,易升华,熔融状态不导电,试回答:
(1)比较Be2+、Li+、H+?微粒半径的大小:______;
(2)写出BeO与NaOH溶液反应的离子方程式(生成Na2BeO2):______;
(3)Be(OH)2、Mg(OH)2可用试剂______鉴别,其离子方程式为______;
(4)BeCl2是______化合物(填“离子”或“共价”).
参考答案:(1)氢元素位于元素周期表的第一周期第ⅠA族,氢离子核外没有电子,锂元素核电荷数为3位于第二周期第ⅠA族,锂离子核外有两个电子,铍元素核电荷数为4,位于第二周期,第ⅡA族,铍离子核外有两个电子,铍离子和锂离子核外均有两个电子,核电荷数大的半径小,故铍离子半径小于锂离子半径,氢离子比铍离子和锂离子少一个电子层,故氢离子半径最小.
故答案为:由大到小依次是Li+、Be2+、H+.
(2)根据对角线法则,铍元素和铝元素位于对角线位置,性质相似,故氧化铍与氧化铝类似,为两性氧化物,故氧化铍与氢氧化钠反应生成相应的偏铍酸盐,故反应的离子方程式为BeO+2OH-=BeO2-+H2O.
故答案为:BeO+2OH-=BeO2-+H2O.
(3)氢氧化铍为两性氢氧化物,氢氧化镁为中强碱,故氢氧化镁不与氢氧化钠反应而氢氧化铍则可以跟氢氧化钠反应,可以用氢氧化钠来鉴别,离子方程式为Be(OH)2+2OH-=BeO22-+2H2O.
故答案为:NaOH溶液;Be(OH)2+2OH-=BeO22-+2H2O.
(4)氯化铝为共价化合物,根据对角线法则铍和铝性质类似,故氯化铍也是共价化合物.
故答案为:共价.
本题解析:
本题难度:一般
3、填空题 今有A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C、B与D分别是同族元素。B、D两元素的质子数之和是A、C两元素质子数之和的2倍。这四种元素中有一种元素的单质呈淡黄色。根据你的推断回答下列问题
(1)四种元素的名称分别是: A_______B_______C_______D_______
(2)请写出含B质量分数最高的化合物的化学式:_____________________
(3)写出由上述元素形成的具有漂白作用的四种物质的化学式:_______、_______、_______、_______
(4)画出C离子结构示意图__________,写出比C少一个质子的原子的电子式______________
(5)分别写出由A、B两元素形成两种化合物的化学式_______________
(6)分别用电子式写出A2B2、C2B2的形成过程_____________________、_____________________
(7)写出NH4Cl的电子式:______________,CO2的电子式:_________________
参考答案:(1)A、氢;B、氧;C、钠;D、硫
(2)H2O2
(3)Na2O2、O3;H2O2;SO2
(4)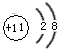 ;
;
(5)H2O、H2O2
(6)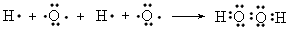 ;
;
(7)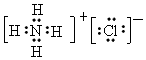 ;
;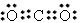
本题解析:
本题难度:一般
4、选择题 X、Y、Z三种元素位于周期表中同一周期,其最高价氧化物对应水化物分别为弱酸、强碱、两性氢氧化物,则这三种元素原子序数的大小顺序是( )
A.X>Y>Z
B.Y>X>Z
C.X>Z>Y
D.Y>Z>X
参考答案:X、Y、Z三种元素位于周期表中同一周期,其最高价氧化物对应水化物分别为弱酸、强碱、两性氢氧化物,则Y为活泼金属、Z为较活泼金属(如Al),X为非金属,
同周期从左向右随原子序数的增大金属性减弱,非金属性增强,
则原子序数为X>Z>Y,
故选C.
本题解析:
本题难度:一般
5、实验题 氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。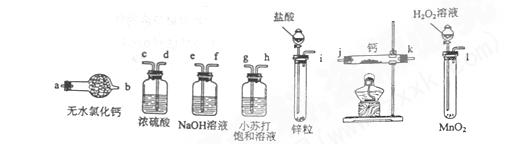
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;_________(请按正确的顺序填入下列步骤的标号)。
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此判断,上述实验确有CaH2生成。
① 写出CaH2与水反应的化学方程式 ___________________;
②该同学的判断不正确,原因是_________________;
(4)请设计实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象______。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________。
参考答案:(10分)
(1)i→e,f→d,c→j,k→a?(2分)
(2)BADC?(2分)
(3)①CaH2+2H2O=Ca(OH)2+H2↑?(2分)
②金属钙与水反应也有类似现象?(1分)
(4)取适量待鉴物,在加热条件下与干燥氧气反应,将反应气相产物通过装有无水硫酸铜的干燥管,若观察到白色变为蓝色,则是氢化钙;否则是钙。?(2分)
(5)氢化钙是固体,携带方便?(1分)
本题解析:略
本题难度:一般