时间:2017-07-10 20:34:30
1、选择题 常温下,pH=8~9的Na2SO3溶液中存在:SO32ˉ+H2O HSO3ˉ+OHˉ,下列说法正确的是
HSO3ˉ+OHˉ,下列说法正确的是
A.加入少量NaOH固体,Kw增大
B.c(OHˉ)= c(HSO3ˉ)+2 c(H2SO3)+ c(H+)
C.c(SO32ˉ)> c(OHˉ) > c(HSO3ˉ)
D.加入稀盐酸,c(HSO3ˉ)减小
参考答案:BC
本题解析:水的离子积只与温度有关,与浓度改变引起的平衡移动无关,加入NaOH固体,维持常温不变,Kw不变,故A错误;根据水的电离方程式可知,亚硫酸钠溶液中由水电离出的氢氧根离子浓度一定等于氢离子浓度,根据盐类水解可知,水电离出的氢离子一部分未被消耗,另一部分被亚硫酸根离子消耗,且有如下两种情况:1个亚硫酸根离子消耗1个氢离子变为1个亚硫酸氢根离子、1个亚硫酸根离子消耗2个氢离子变为1个亚硫酸分子,由于微粒数之比等于浓度之比,则水电离出的氢离子浓度=溶液中的氢离子浓度+亚硫酸氢根离子浓度+亚硫酸浓度×2=水电离出的氢氧根离子浓度,故B正确;亚硫酸根离子分两步水解:SO32ˉ+H2O HSO3ˉ+OHˉ、HSO3ˉ+H2O
HSO3ˉ+OHˉ、HSO3ˉ+H2O H2SO3+OHˉ,但是第一步水解程度较弱,第二水解程度更弱,两步水解都生成OHˉ,所以溶液中c(SO32ˉ)> c(OHˉ) > c(HSO3ˉ),故C正确;盐酸与氢氧根离子易反应,能减小氢氧根离子浓度,使亚硫酸根离子的水解平衡右移,则c(HSO3ˉ)增大,故D错误。
H2SO3+OHˉ,但是第一步水解程度较弱,第二水解程度更弱,两步水解都生成OHˉ,所以溶液中c(SO32ˉ)> c(OHˉ) > c(HSO3ˉ),故C正确;盐酸与氢氧根离子易反应,能减小氢氧根离子浓度,使亚硫酸根离子的水解平衡右移,则c(HSO3ˉ)增大,故D错误。
本题难度:简单
2、选择题 下列溶液呈中性的是
A.pH=7的溶液
B.c(H+) = c(OH-)的溶液
C.由强酸、强碱等物质的量反应制得的溶液
D.非电解质溶于水得到的溶液
参考答案:B
本题解析:只要溶液中氢离子浓度和OH-浓度相等,溶液就显中性,所以只有选项B是正确的,其余都是错误的,答案选B。
本题难度:一般
3、选择题 下列物质加入水中,能使水的电离程度增大,且所得溶液显酸性的是(?)
A.CH3COOH
B.Al2(SO4)3
C.NaHSO4
D.Na2CO3
参考答案:B
本题解析:能水的电离程度增大的措施有:升高温度、加入能水解的盐、电解、加入活泼的金属;所以正确选项为B;
本题难度:一般
4、实验题 (8分)50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题: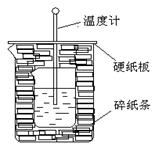 ?
?
(1)从实验装置上看,有两处缺点,其一是有处错误安装会导致热量散失较大,应该改正为? ,其二尚缺少一种玻璃仪器,这玻璃仪器名称是?
(2)烧杯间填满碎纸条的作用是?。
(3)若大烧杯上不盖硬纸板,求得的反应热数值?(填“偏大”“偏小”或“无影响”)。
(4)实验中该用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量?(填“相等”或“不相等”),所求中和热?(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会
?(填“偏大”、“偏小”或“无影响”)。
(6)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差t2-t1分别为2.2℃ 2.4℃ 3.4℃,则最终代入计算式的温差均值为?℃
参考答案:(1)小烧杯和大烧杯的杯口应相平、环形玻璃搅拌棒
(2)保温(或隔热、或减少热损失)?(3)偏小?
(4)不相等、相等?(5)偏小?(6)2.3
本题解析:(1)根据装置图可知,小烧杯和大烧杯的杯口没有相平,会导致热量损失。实验中需要搅拌,所以还缺少环形玻璃搅拌棒。
(2)该实验要尽可能的减少热量的损失,所以烧杯间填满碎纸条的作用是保温(或隔热、或减少热损失)。
(3)若大烧杯上不盖硬纸板,热量会损失,因此求得的反应热数值偏小。
(4)改变酸或碱的用量,放出的热量会变化,但中和热是不变的,因为中和热是稀溶液中酸和碱作用生成1mol水时反应所放出的热量。
(5)氨水是弱碱,存在电离平衡。由于电离是吸热的,所以测得的中和热数值会偏小。
(6)根据数据可知,实验③的误差大,舍去,所以温度差的平均值是(2.2℃+2.4℃)÷2=2.3℃.
本题难度:一般
5、填空题 (10分)现在城市居民使用的管道煤气的主要成分是H2、CO和少量CH4。H2、CO和CH4的燃烧热数据如下表
| 物质 | H2 | CO | CH4 |
| 燃烧热kJ?mol-1 | 285.8 | 283.0 | 890.3 |
参考答案:(1) H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8KJ/mol;CO(g)+ 1/2O2(g)= CO2(g) ΔH=-283.0KJ/mol ;CH4(g)+2O2(g)= CO2(g)+2H2O(l) ΔH=-890.3KJ/mol ;(2)空气、天然气;0.44.
本题解析:(1)根据表格中物质的燃烧热的数值可知:H2、CO和CH4燃烧的热化学方程式是(1) H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8KJ/mol;CO(g)+ 1/2O2(g)= CO2(g) ΔH=-283.0KJ/mol ;CH4(g)+2O2(g)= CO2(g)+2H2O(l) ΔH=-890.3KJ/mol ;(2)作为开发西部的西气东输工程的重要成就,西部天然气已全面进入上海、江苏境内,使用管道煤气用户改用天然气,由于单位体积的天然气消耗的氧气量大,所以应调整灶具进气量阀门,即增大空气的进入量或减少天然气的进入量。据报道,同时燃气价格也将在现有的0.95元/m3的基础上调整到1.31元/m3,由于1mol的管道煤气燃烧放出热量是(283.0+285.8)KJ÷2=284.4KJ;1mol的天然气放出热量是890.3KJ,所以若居民保持生活水平不变,即消耗的能量不变,因此需要消耗天然气的物质的量的煤气的284.4KJ÷890.3KJ=0.32倍,原来消耗1m3,花费0.95元,则消耗的天然气的体积是0.32m3,需要花费:0.32m3×1.31元/m3=0.42元,所以在消耗燃气方面的消费大约是现在的倍数关系是:0.42元÷0.95元=0.44(倍),故更经济。
考点:考查燃烧热的热化学方程式的书写、燃烧不同燃料的灶具的改造方法、花费大小的比较的计算。
本题难度:一般