时间:2017-07-10 20:26:41
1、填空题 (16分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 ==6SO2+Fe3O4,氧化产物为?,若有3 mol FeS2参加反应,
==6SO2+Fe3O4,氧化产物为?,若有3 mol FeS2参加反应,
转移?mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为?。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为?(用离子方程表示)?
(4)①钢铁的电化腐蚀简单示意图如右,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式?。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为?。
参考答案:(1)SO2、Fe3O4? 32?(2)2Fe3++Cu=2Fe2++Cu2+?(3)Fe3++3H2O  Fe(OH)3胶体+3H+
Fe(OH)3胶体+3H+
(4)①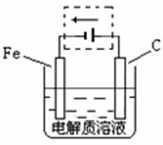 ?②O2+2H2O+4e-=4OH-?(5)11.2g
?②O2+2H2O+4e-=4OH-?(5)11.2g
本题解析:(1)根据方程式可知,FeS2中Fe和S的化合价分别从+2价升高到+8/3价和从-1价升高到+4价,所以FeS2是还原剂,SO2和四氧化三铁都是氧化产物;若有3 mol FeS2参加反应,转移电子的物质的量是(2+6×5)=32mol。
(2)铁离子具有氧化性,能氧化单质铜,方程式2Fe3++Cu=2Fe2++Cu2+。
(3)硫酸铁溶于水电离出的铁离子能水解生成氢氧化铁胶体,胶体具有吸附性,所以可作净水剂,方程式为Fe3++3H2O  Fe(OH)3胶体+3H+。
Fe(OH)3胶体+3H+。
(4)①该装置是铁的电化学腐蚀,所以要保护铁,则可以通过外接电流的阴极保护法,即铁和电源的负极,作阴极,碳和电源的正极相连,作阳极,如同所示。
②原电池中负极失去电子,正极得到电子,所以正极反应式是O2+2H2O+4e-=4OH-。
(5)盐酸是0.8mol,生成的氢气是0.1mol,所以和氧化铁中氧元素结合的氢原子是0.6mol,因此氧化铁是0.1mol,生成0.2mol氯化铁。0.2mol氯化铁消耗铁是0.1mol,生成氢气消耗铁是0.1mol,所以参加反应的铁是0.2mol,质量是11.2g。
本题难度:一般
2、选择题 铜的冶炼大致可分为:
(1)富集,将硫化物矿进行浮选;?
(2)焙烧,主要反应为2Cu+FeS2+4O2 Cu2S+3SO2+2FeO(炉渣);
Cu2S+3SO2+2FeO(炉渣);
(3)制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2 2Cu2O+2SO2,2Cu2O+Cu2S
2Cu2O+2SO2,2Cu2O+Cu2S 6Cu+SO2;
6Cu+SO2;
(4)电解精炼。
下列说法正确的是( )?
A.上述灼烧过程的尾气均可直接排到空气中?
B.由6 mol CuFeS2生成6 mol Cu,上述共消耗15 mol O2?
C.在反应2Cu2O+Cu2S 6Cu+SO2中,作氧化剂的只有Cu2O
6Cu+SO2中,作氧化剂的只有Cu2O
D.电解精炼时,粗铜应与外电源正极相连?
参考答案:BD
本题解析:由于灼烧产生的SO2直接排放到大气中会造成大气污染,所以A项错误;根据上述反应可知每产生1 mol铜需要消耗2.5 mol氧气,所以B项正确;在反应2Cu2O+Cu2S 6Cu+SO2中,作氧化剂的有氧化亚铜和硫化亚铜。
6Cu+SO2中,作氧化剂的有氧化亚铜和硫化亚铜。
本题难度:一般
3、填空题 聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+.实验步骤如下:
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有______.
(a)玻璃棒 (b)烧杯? (c)烧瓶
(2)步骤II取样分析溶液中Fe2+、Fe3+的含量,目的是______和确定氧化Fe2+所需NaClO3的量:
(a)?控制溶液中Fe2+与Fe3+含量比 (b)?确保铁的氧化物酸溶完全? (c)?确定下一步还原所需铁的量
(3)完成步骤IV中的氧化还原反应:补充产物并配平:
______?Fe2++______ClO3-+______H+=______Fe3++Cl-+______
(4)聚合硫酸铁溶液中SO42?与Fe3+物质的量之比不是3:2.根据下列提供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42?与Fe3+物质的量之比.测定时所需的试剂______.
(a)?NaOH (b)?FeSO4 (c)?BaCl2 (d)?NaClO3
需要测定Fe2O3和______的质量(填写化合物的化学式).
参考答案:(1)配制一定量分数硫酸溶液需要的仪器有:胶头滴管、量筒、玻璃棒、烧杯,故选:ab;?
(2)因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,所以确定下一步还原所需铁的量,然后Fe2+再被氧化Fe3+,需要确定氧化Fe2+所需NaClO3的量,故选:C;?
(3)Fe2+由+2价升高到+3价,ClO3-中Cl的化合价从+5价降低到-1价,得6Fe2++ClO3-+H+--6Fe3++Cl-,由电荷守恒、质量守恒得:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,故答案为:6;1;6;3H2O;
(4)因SO42?与Fe3+都采用沉淀法加以测定,根据测定Fe2O3来测定Fe3+的物质的量,根据测定?BaSO4的质量来测定SO42?的物质的量;故答案为:ac;?BaSO4
本题解析:
本题难度:简单
4、填空题 (4分)把卷成螺旋状的铜丝在酒精灯外焰上加热,使表面变黑,然后迅速伸到无 水酒精中,有什么现象?
水酒精中,有什么现象? ?铜丝在反应中起?的作用,写出这个反应的化学方程式?
?铜丝在反应中起?的作用,写出这个反应的化学方程式? ?。
?。
参考答案:略
本题解析:略
本题难度:简单
5、选择题 下列物质不能由铜单质与其它物质发生化合反应得到的是(?)
A.CuO
B.CuS
C.Cu2S
D.CuCl2
参考答案:B
本题解析:略
本题难度:简单