时间:2017-07-10 20:08:57
1、选择题 下列电子式中书写错误的是
[? ]
A.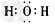
B.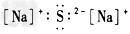
C.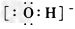
D.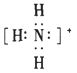
参考答案:BD
本题解析:
本题难度:简单
2、填空题 (6分)X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题: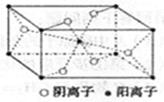
(1)Y基态原子的电子排布式是?。
(2)R2+的水合离子中,提供孤电子对的原子是?。
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数比是?。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是?。
参考答案:(1)1s22s22p4 ;(2)O;?(3)2:1 (4)2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
本题解析:根据题意可推知:X是N;Y是O;Z是Mg;R的Cu。(1)O基态原子的电子排布式是1s22s22p4 ; (2)Cu2+的水合离子中,提供孤电子对的原子是H2O分子中的O原子;(3)根据晶胞结构示意图可知:阳离子:1+8÷1/8=2;阴离子:4×1/2+2=4.所以晶胞中阴离子与阳离子的个数比是4:2 = 2:1。(40根据题意,结合电子守恒、原子守恒可得相应反应的离子方程式:2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O。
本题难度:一般
3、选择题 下列说法正确的是( )
①水银不是银②干冰不是冰③铅笔不含铅④金刚石不含金.
A.①④
B.②
C.②③
D.①②③④
参考答案:D
本题解析:
本题难度:简单
4、填空题 (15分)已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;B在第三周期且化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,位于第四周期第IB族,请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为?。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点?(填高或低),理由是?。
(3)E的最高价氧化物分子的空间构型是?。
(4)F的核外电子排布式是?,F的高价离子与A的简单氢化物形成的配离子的化学式为?.
(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为?;(黑色球表示F原子)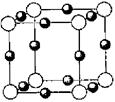
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为?。
参考答案:(1)Na<Al<Si<N(2分)
(2)高(1分)NaCl为离子晶体而SiCl4为分子晶体(2分)
(3)平面正三角形(2分)
(4)1s22s22p63s23p63d104s1(或 3d104s1)(2分)?2+(2分)
(5)Cu3 N?(2分)?(6)共价键(2分)
本题解析:根据元素的结构及有关性质可知N、Na、Al、Si、S、Cu。
(1)非金属性压强,第一电离能越大,所以A、B、C、D的第一电离能由小到大的顺序为Na<Al<Si<N。
(2)由于NaCl为离子晶体而SiCl4为分子晶体,所以氯化钠的熔点高于SiCl4的。
(3)在三氧化硫中S原子的孤对电子对数是(6-2×3)÷2=0,所以三氧化硫是平面三角形结构。
(4)根据构造原理可知,Cu原子的核外电子排布式为1s22s22p63s23p63d104s1(或 3d104s1)。铜离子和氨气形成的是配位键,其中氨气是配体,化学式为[Cu(NH)3]42+。
(5)根据晶胞结构可知,氮原子数是8×1/8=1,铜原子数是12×1/4=3,所以化学式为Cu3 N。
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,这说明该晶体是原子晶体,含有的化学键是共价键。
本题难度:一般
5、填空题 (8分)含羟基的化合物可表示为M—OH(M不确定);当它与H+结合可后形成M—OH+
2离子(有机反应中的重要中间体);在一定条件下,易失去H+或H2O分子。请回答:
(1)符合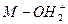 通式最简单的离子的电子式为____________________________________。
通式最简单的离子的电子式为____________________________________。
(2)粒子中原子数、电子数都相等的粒子称为等电子体。等电子体有相似的几何形状,上面(1)题中离子的几何形状为_____________________________。
(3)同温同压下,由A.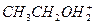 ;B.
;B.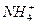 ;C.
;C.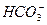 三者分别形成的水溶液酸性由强到弱的顺序为____________________(填序号)。
三者分别形成的水溶液酸性由强到弱的顺序为____________________(填序号)。
(4)液态乙醇中存在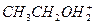 ,可与之相互中和而使液体呈中性的粒子为__________。
,可与之相互中和而使液体呈中性的粒子为__________。
参考答案:(1)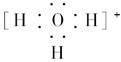 ? (2)三角锥形? (3)A、B、C? (4)C2H5O-
? (2)三角锥形? (3)A、B、C? (4)C2H5O-
本题解析:本题的突破口为M元素,符合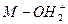 ,通式最简单的离子M为H,即H3O+。
,通式最简单的离子M为H,即H3O+。
(2)中由等电子体几何形状相似,可知H3O+与NH3结构相似,为三角锥形。(3)问中也可根据题中信息,知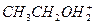 易失去H+使溶液显较强酸性,而
易失去H+使溶液显较强酸性,而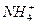 和
和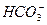 可由水解反应去判断其酸性强弱。(4)中由题给信息易得出另一种粒子为C2H5O-。
可由水解反应去判断其酸性强弱。(4)中由题给信息易得出另一种粒子为C2H5O-。
本题难度:简单