时间:2017-07-10 20:07:06
1、选择题 下列关于盐酸与醋酸两种稀溶液的说法正确的是(?)?
A.相同浓度的两溶液中c(H+)相同
B.100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液都稀释10倍,盐酸的pH大于醋酸的PH
D.两溶液中分别加人少量对应的钠盐,c(H+)均明显减小
参考答案:BC
本题解析:A.盐酸是强酸,完全电离,醋酸是弱酸,只有部分发生电离。当两种酸的浓度相等时电离产生的氢离子的浓度盐酸的大于醋酸的。错误。B.盐酸和醋酸都是一元酸,当二者的物质的量相等时中和碱的能力相等,即消耗的碱物质的量相等。正确。C.pH=3的两溶液都稀释10倍,盐酸的pH等于4.醋酸由于是弱酸,存在电离平衡,未电离的电解质分子会继续电离产生氢离子。使的氢离子的浓度比盐酸大。所以醋酸的PH?要比盐酸的小。正确。D.两溶液中分别加人少量对应的钠盐,c(H+)盐酸的不变,醋酸的电离平衡受到抑制,所以c(H+)明显减小。错误。
本题难度:一般
2、选择题 下列关于电解质溶液的正确判断是
[? ]
A.在pH =12的溶液中,K+、Cl-、Al3+、Na+可以共存
B.在pH=0的溶液中,Na+、NO3-、CO32-、K+可以共存
C.由0.1mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH-
D.由0.1mol·L-1一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2O HA+OH-
HA+OH-
参考答案:D
本题解析:
本题难度:一般
3、选择题 等浓度的下列稀溶液:①乙酸 ②盐酸 ③碳酸 ④硫酸,它们的pH由小到大排列正确的是
A.①②③④
B.③①②④
C.④②③①
D.④②①③
参考答案:D
本题解析:由pH=-lgc(H+),c(H+)越大pH值越小,硫酸是二元强酸,盐酸是一元强酸,乙酸和碳酸是弱酸且乙酸酸性比碳酸强,所以答案选D。
考点:pH
本题难度:一般
4、选择题 下图是某“泡腾片”的标签。将这样一粒泡腾片放入水中,药片完全溶解,同时产生大量气泡,这个过程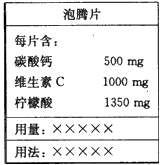
[? ]
A.溶解了500 mg的Ca2+
B.释放了224mL(标准状况)的气体
C.发生了反应:CO32-+2H+==CO2↑+H2O
D.说明了柠檬酸的酸性比碳酸强
参考答案:D
本题解析:
本题难度:一般
5、填空题 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答: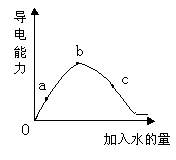
⑴“O”点导电能力为0的理由是:?。
⑵a、b、c三点溶液中,[H+]由小到大的顺序是:?。
⑶a、b、c三点溶液中,醋酸的电离程度最大的是:?。
⑷若使c点溶液中[CH3COO-]增大,而[H+]减小,可采取的措施主要有:①?;②?;③?;④?。
参考答案:⑴冰醋酸未电离,其中没有自由移动的离子;⑵c<a<b;⑶c;⑷①CH3COOH;②NaOH;③Na2CO3;④Mg。
本题解析:⑴冰醋酸未电离,其中没有自由移动的离子;⑵导电能力越强,自由移动的离子浓度越大,故[H+]由小到大的顺序是c<a<b;⑶随着加水的量的增加,将促进醋酸的电离,故c点醋酸的电离程度最大;⑷使醋酸溶液中的CH3COO-溶液增大,可加入物质与H+反应使醋酸电离平衡向电离的方向移动,如氢氧化钠、碳酸钠及金属镁;而加入醋酸钠,虽使醋酸电离平衡向左移动,但剩余的CH3COO-的浓度仍是增加的,所以加入醋酸钠也符合题意。
本题难度:一般