时间:2017-07-10 19:56:25
1、选择题 下列各组物质的燃烧热相等的是( )
A.碳和一氧化碳
B.1moL碳和2moL碳
C.1moL乙炔和2moL碳
D.淀粉和纤维素
参考答案:B
本题解析:燃烧热指的是1mol可燃物完全燃烧生成稳定的物质放出的热量,A项两物质不一样,燃烧热不同;B项物质一样,燃烧热相等,与燃烧的物质的量无关;C项、D项与A项相同。
考点:考查燃烧热的概念。
点评:注意燃烧热是物质固有属性,与物质的质量或物质的量的多少无关。属于简单题。
本题难度:一般
2、填空题 利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、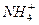 、Cl一四种离子,且c(
、Cl一四种离子,且c(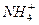 )>c(Cl-)>c(OH-)>c(H+),则这两种溶质是_____________。
)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是_____________。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:______________________。
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是_____________。
(4)以石墨电极电解100 mL 0.1 mol·L-1CuSO4溶液。若阳极上产生气体的物质的量为0.01 mol,则阴极上析出Cu的质量为__________g。
(5)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如右图所示,B点溶液的pH=7(假设体积可以直接相加),则c(HCl)=_______mol·L-1.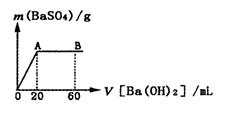
(6)在温度、容积相同的3个密闭容器中,按下表投入反应物,发生反应(H2(g)+I2(g) 2HI(g)?△H=-14.9 kJ·mol-1),在恒温、恒容条件下,测得反应达到平衡时的数据如下表:
2HI(g)?△H=-14.9 kJ·mol-1),在恒温、恒容条件下,测得反应达到平衡时的数据如下表:
下列说法正确的是_______________。
A.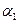 +
+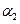 =1
=1
B.2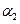 =
=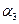
C.a+b=14.9
D.c1=c2=c3
参考答案:(1)NH4Cl和 NH3·H2O?(2分)
(2)NH4++ H2O NH3?H2O + H+?(2分)
NH3?H2O + H+?(2分)
(3)R2Z > RX > RY ?(2分)
(4)0.64?(2分)
(5)0.2?(3分)
(6)A? C?(3分)
本题解析:略
本题难度:简单
3、选择题 下列说法正确的是
[? ]
A.HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3) kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
参考答案:B
本题解析:
本题难度:简单
4、选择题 某温度下,水的离子积约为1×10-12,将Va L pH=2的硫酸溶液与Vb L pH=11的NaOH溶液混合,若混合溶液的pH=10,体积是(Va+Vb) L,则Va∶Vb为 (? )
A.2∶11
B.2∶9
C.11∶2
D.9∶2
参考答案:D
本题解析:略
本题难度:一般
5、填空题 Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:
(1)该合成路线对于环境保护的价值在于?。
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因?。
(3)CH3OH、H2的燃烧热分别为:△H=-725.5 kJ/mol、△H=-285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:?。
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g)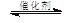 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
参考答案:(1)有利于防止温室效应 (2分)
(2)HOCH2CH2NH2+H2O HOCH2CH2NH3++OH-?(2分)
HOCH2CH2NH3++OH-?(2分)
(3)CO2(g)+3 H2(g)= CH3 OH(l)+ H2O(l) △H=-131.9kJ/mol?(3分)
(4)<? (1分),<? (1分)
(5) CH3 OCH3 -12e-+16 OH-=2CO32-+11 H2O? (3分 )
(6)9.6(2分 )
本题解析:(1)氢气与二氧化碳合成甲醇,减少了二氧化碳的排放,有利于防止温室效应
(2)HOCH2CH2NH2水解使溶液呈碱性,发生的离子方程式为HOCH2CH2NH2+H2O HOCH2CH2NH3++OH-
HOCH2CH2NH3++OH-
(3)根据盖斯定律,将甲醇与氢气的燃烧热化学方程式作相应调整,得△H=-285.8 kJ/mol×3-(-725.5 kJ/mol)=-131.9kJ/mol,所以合成甲醇的热化学方程式为CO2(g)+3 H2(g)= CH3 OH(l)+ H2O(l) △H=-131.9kJ/mol
(4)随温度升高,二氧化碳的转化率降低,说明升温平衡向逆向移动,正反应方向为放热反应,△H<0,反应物气体的总物质的量是8mol,生成物气体的总物质的量是4mol,所以△S<0;
(5)该电池负极是甲醚发生氧化反应,碱性介质中生成碳酸根离子,电极反应式为CH3 OCH3 -12e-+16 OH-=2CO32-+11 H2O
(6)0.5min甲醚的通入量是0.025mol,转移电子是0.3mol,根据得失电子守恒,Cu2++2e-=Cu,最终得0.15mol铜,其质量是9.6g。
本题难度:一般