时间:2017-07-10 19:56:03
1、选择题 下列说法不正确的是
A.原电池负极被氧化
B.任何化学反应都能设计成原电池
C.化学反应的速率和限度均可通过改变化学反应条件而改变
D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变
参考答案:B
本题解析:电子的定向移动形成电流,所以只有氧化还原反应才能设计成原电池,B不正确。其余都是正确的,答案选B。
本题难度:困难
2、选择题 瑞典ASES公司设计的曾用于驱动潜艇的液氨—液氧燃料电池示意图如下图所示,有关说法正确的是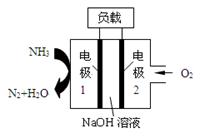
A.电极2发生氧化反应
B.电池工作时,Na+ 向负极移动
C.电流由电极1经外电路流向电极2
D.电极1发生的电极反应为:2NH3+6OH—-6e-=N2↑+6H2O
参考答案:D
本题解析:A.电极2通入的是氧气,是电源的正极,发生还原反应,A错误;B.电池工作时,阳离子Na+ 向正极移动,B错误;C.电极1是负极,则电流由电极2经外电路流向电极1,C错误;D.电极1是负极,失去电子,发生氧化反应,则发生的电极反应为:2NH3+6OH—-6e-=N2↑+6H2O,D正确,答案选D。
考点:考查原电池原理的应用
本题难度:一般
3、填空题 (14分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图: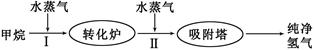
(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1[来源:] |
| B | 0、0、2、2 | c2 | Q2 | α2 ? |
| C | 2、2、0、0 | c3 | Q3 | α3 |
参考答案:(1)放;66.7%(2)AD (3)②③(4)降低温度,或增加水蒸汽的量,或减少氢气的量;(每格2分)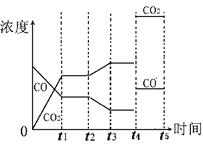
本题解析:(1)温度越高,平衡常数越小,所以正反应是放热反应。
CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
起始量(mol)? 1? 2? 0? 0
转化量(mol)? x? x? x? x
平衡量(mol)? 1-x? 2-x? x? x
根据平衡常数知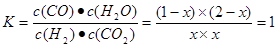
解得x=2/3,所以平衡后CO的转化率为是66.7%。
(2)因为反应前后体积,即改变压强平衡不会发生移动,根据所给的反应物投入量来看ABC就是等效的,虽然氢气的含量,但氢气的浓度不同,其中BC相等且都是A的2倍。根据500℃平衡常数可计算出A中反应物的转化率均是75%【计算方法同(1)】,即平衡时A中CO、H2O、H2、CO2分别是0.25mol、0.25mlol、0.75mol、0.75mol,则平衡时B、C中CO、H2O、H2、CO2分别都为0.5mol、0.5mol、1.5mol、1.5mol。即B、C中转化率分别是25%和75%。A中放热Q1,所以反应热是-2Q1kJ·mol-1。则C中放热2Q1,B中吸热Q1。答案AD正确。
(3)因为体系绝热,而反应是放热反应,所以压强会发生变化,①⑤可以。反应前后气体质量和容器的体积均不发生变化,所以密度不变,②不可以。反应前后气体质量和物质的量均不发生变化,所以相对分子质量不变,③不可以。④⑥符合化学平衡的概念正确。答案是②③。
(4)由图像可知t2时刻CO浓度减小,CO2浓度增大,因此改变的条件是降低温度,或增加水蒸汽的量。t4时刻通过改变容积的方法将压强增大为原先的两倍,平衡不移动,但物质的浓度均增大,都变为原来大2倍,如图所示: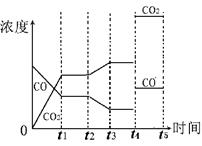
本题难度:一般
4、选择题 由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的酸性( )
A.不变
B.逐渐减弱
C.逐渐增强
D.先减弱,后增强
参考答案:铜、锌和稀硫酸组成的原电池工作时的电池反应为:Zn+2H+=H2↑+Zn2+,消耗氢离子,所以电解质溶液的酸性减弱.
故选B.
本题解析:
本题难度:一般
5、填空题 (14分)电化学是研究电能与化学能相互转化的科学。请回答:
(1)原电池是将?能转化为?能的装置,一般较活泼的金属做 ?极,发生?反应。电子流向?极(填“正”或“负”)。
(2)分析右图,写出有关的电极反应式:??
锌棒上的电极反应式为 ??
碳棒上的电极反应式为?
参考答案:(1)化学?电?负极?氧化?正极 (2)? Zn–2e-=Zn2+? Cu2++2e-=Cu
本题解析:(1)原电池是将化学能转化为电能的装置,一般较活泼的金属做负极,失去电子,发生氧化反应。电子由负极流向正极。
(2)锌是活泼的金属,所以锌是负极,失去电子,电极反应式是Zn–2e-=Zn2+。碳棒是正极,溶液中的铜离子得到电子,发生还原反应,电极反应式是Cu2++2e-=Cu。
点评:该题是高考中的重要考点,属于基础性试题的考查。试题基础性强,侧重对学生基础知识的巩固与训练。该题的关键是明确原电池的工作原理,并能结合题意灵活运用即可。
本题难度:一般