时间:2017-07-10 19:56:03
1、填空题 (14分)砷(As)广泛分布于自然界,其原子结构示意图是 。
。
(1)砷位于元素周期表中 族,其气态氢化物的稳定性比NH3 (填“强”或“弱”)。
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据下图写出As2O5分解为As2O3的热化学方程式: 。
(3)砷酸盐可发生如下反应:AsO43-+2I
参考答案:
本题解析:
本题难度:困难
2、实验题 (6分)如下图所示的装置,在盛有水的烧杯中,铁圈和银圈的相接处吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入CuSO4溶液。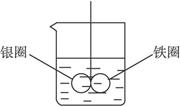
(1)片刻后可观察到的现象是_________ (指悬吊的金属圈)。
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜
(2)产生上述现象的原因是_________。
参考答案:(1)D(2)加入CuSO4(aq)后,形成FeAg原电池。Fe溶解,铁圈减轻,Cu2+在Ag圈上得电子析出,银圈增重
本题解析:形成FeAg原电池。Fe极质量减轻:Fe-2e- Fe2+,Ag极质量增重:Cu2++2e-
Fe2+,Ag极质量增重:Cu2++2e- Cu。故银圈向下倾斜。
Cu。故银圈向下倾斜。
本题难度:简单
3、填空题 在A、B、C三个烧杯中分别盛有相同浓度的稀硫酸,如下图所示:
(1)A中反应的离子方程式为_________________________。
(2)B中Sn极的电极反应式为_________________________,Sn极附近溶液的pH____(填“增大”、“减小”或“不变”)。
(3)C中被腐蚀的金属是___,总反应式为__________________________(写离子方程式)。
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是_______________。
参考答案:(1)Fe+2H+ = Fe2++H2↑
(2)2H++2e- = H2↑;增大
(3)Zn;Zn+2H+ = Zn2++H2↑
(4)B >A>C
本题解析:
本题难度:一般
4、填空题 某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针 偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
参考答案:(1)不相同, (2)负极:2Al-6e-=2Al3+正极:6H++6e-=3H2↑总反应:2Al+6H+=2Al3++3H2↑(
(3)负极(1分) 因为Al能和NaOH溶液反应而Mg不能(2分)
本题解析:(1)实验1中,氧化还原反应发生在金属镁和稀盐酸之间,失电子的是金属镁,作负极,铝作正极;实验2中,氧化还原反应发生在金属铝和稀盐酸之间,失电子的是金属铝,铝作负极,所以实验1、2中Al所作的电极不相同;(2)Al、石墨、盐酸构成的原电池中,较活泼的金属铝做负极,电极反应为:2Al-6e-→2Al3+;石墨电极为正极,电极反应为:6H++6e-→3H2↑,总反应:2Al+6H+=2Al3++3H2↑;(3)实验4中,金属铝和氢氧化钠发生氧化还原反应,失电子的是金属铝,为原电池的负极。
考点:考查原电池原理。
本题难度:一般
5、选择题 化学电池可以直接将化学能转化为电能,化学电池的本质是( )
A.化合价的升降
B.化合反应
C.氧化还原反应
D.电能的储存
参考答案:A.化合价的升降为化学电池中反应的特征,故A不选;
B.化合反应不一定为氧化还原反应,故B不选;
C.氧化还原反应是化学电池的本质,故C选;
D.电能的储存不是电池的本质,故D不选;
故选C.
本题解析:
本题难度:简单