时间:2017-07-10 19:42:44
1、简答题 工业上对海水资源综合开发利用的部分工艺流程如图所示.
(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽.离子膜和隔膜均允许通过的分子或离子是______.电解槽中的阳极材料为______.
(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?______,原因是______.
(3)溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取______.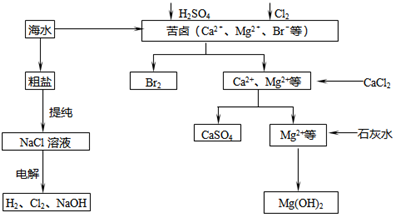
参考答案:(1)电解饱和食盐水,电解槽离子膜或隔膜,允许阳离子(或Na+)和水分子通过,不允许阴离子通过;阳极生成氯气,用石墨做电极;
故答案为:(1)阳离子(或Na+)和水分子;石墨;
(2)工艺流程中先后制得Br2、CaSO4和Mg(OH)2,不能沉淀Mg(OH)2,硫酸钙为微溶物,如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,使产品不纯.
故答案为:(2)否.如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯;
(3)因为溴单质在四氯化碳中的溶解度比在水中大得多,而且四氯化碳与水不互溶,因此可用于萃取,但也有缺点,如四氯化碳萃取法工艺复杂、设备投资大;经济效益低、环境污染严重.
故答案为:(3)四氯化碳萃取法工艺复杂、设备投资大;经济效益低、环境污染严重.
本题解析:
本题难度:一般
2、选择题 下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,会降低反应速率,可提高N2、H2的转化率
B.从海水中提镁过程中,电解熔融MgO可制备Mg
C.电解精炼铜时,同一时间内阳极溶解固体的质量比阴极析出固体的质量小
D.电解饱和食盐水制烧碱采用离子交换膜法,可来源:91考试网 www.91exAm.org防止阴极室产生的Cl2进入阳极室
参考答案:C
本题解析:A、合成氨生产过程中将NH3液化分离,会降低逆反应速率,但不会降低正反应速率,A错误;B、制备Mg应电解熔融MgCl2,B错误;C、电解精炼铜,阳极除了Cu失电子,还有比铜活泼的锌、镍、铁失电子,C正确;D、电解饱和食盐水时用离子交换膜法,防止阳极室产生的Cl2进入阴极室,D错误;答案选C。
考点:考查化学与化工生产。
本题难度:一般
3、选择题 用电解水的方法分析水的组成时,需要加入一些电解质以增强水的导电性,不宜加入的物质是
A.Na2SO4
B.NaNO3
C.KOH
D.Cu SO4
参考答案:D
本题解析:电解硫酸铜溶液时生成物是铜、氧气和硫酸,即电解的物质不再是水,所以并能加入硫酸铜,其余选项都是正确的,答案选D。
点评:该题是基础性试题的考查,试题注重基础,侧重对学生能力的培养与基础知识的巩固与训练,有利于培养学生的灵活应变能力。该题的关键是明确电解池中离子的放电顺序,然后结合题意灵活运用即可。
本题难度:简单
4、填空题 在玻璃圆筒中盛有两种无色的互不相溶的中性液体,上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如图.接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.根据上述实验回答:
(1)阳极上的电极反应式为________.
(2)阴极上的电极反应式为________.
(3)原上层液体是________.
(4)原下层液体是________.
(5)搅拌后两层液体颜色发生变化的原因是__________________________________.
(6)要检验上层液体中含有的金属离子,其方法是______________________________,现象是__________________________________.
参考答案:(1)2I--2e-===I2
(2)2H++2e-===H2↑
(3)KI(或NaI等)水溶液
(4)CCl4(或CHCl3等)
(5)I2在CCl4中的溶解度大于在水中的溶解度,所以绝大部分I2都转移到CCl4中
(6)焰色反应;透过蓝色钴玻璃观察火焰呈紫色(答案合理即可)
本题解析:
本题难度:一般
5、选择题 500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO3- )=0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体1.12 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(Na+)=0.2 mol·L-1
B.电解后溶液中c(H+)=0.2 mol·L-1
C.上述电解过程中共转移0.4 mol电子
D.电解后得到的Cu的物质的量为0.1 mol
参考答案:B
本题解析:本题考查了电解原理、化学计算等,意在考查考生的分析能力及计算能力。阳极是阴离子放电(?电能力:OH->NO3- ),根据题给信息,阳极一定是OH-放电,生成0.05 mol氧气,转移0.2 mol电子;阴极离子放电能力:Cu2+>H+>Na+,所以Cu2+先放电,然后是H+放电,阴极生成0.05 mol氢气时,转移0.1 mol电子,根据得失电子守恒知,Cu2+转移0.1 mol电子,n(Cu2+)=0.05 mol。所以原溶液中n[Cu(NO3)2]=0.05 mol,n(NO3- )=0.3 mol/L×0.5 L=0.15 mol,n(NaNO3)=0.05 mol。原混合溶液中c(Na+)=0.1 mol·L-1,A项错误;结合以上分析及电解总方程式Cu2++2H2O Cu+H2↑+O2↑+2H+可知,生成0.05 mol Cu、0.05 mol O2、0.05 mol H2和0.1 mol H+,电解后溶液中c(H+)=
Cu+H2↑+O2↑+2H+可知,生成0.05 mol Cu、0.05 mol O2、0.05 mol H2和0.1 mol H+,电解后溶液中c(H+)=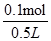 =0.2 mol·L-1,B项正确,D项错误;上述电解过程中共转移0.2 mol电子,C项错误。
=0.2 mol·L-1,B项正确,D项错误;上述电解过程中共转移0.2 mol电子,C项错误。
本题难度:一般