时间:2017-07-10 19:35:00
1、推断题 一种常用融雪剂的主要成分的化学式为XY2,X原子的结构示意图为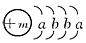 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该融雪剂的化学式为________。
(2)Z、W元素的名称为________、________
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________.
A.XY2的电子式: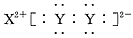
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-===2Y-+Z↓
D.用电子式表示XY2的形成过程为: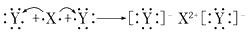
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是_____________________。
参考答案:(1)20;CaCl2
(2)硫;碳
(3)B
(4)BD
(5)水分子间存在氢键
本题解析:
本题难度:一般
2、简答题 A.B.C.D.E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E与其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应,D的单质为淡黄色固体.根据以上信息,回答下列问题:
(1)A和D的氢化物中,稳定性较弱的是______选填A或D);A和B的离子中,半径较小的是______填离子符号?).
(2)元素C在元素周期表中的位置是______.(3)E元素的名称是______.
(4)写出C、D的最高价氧化物的水化物之间反应的离子方程式______.
参考答案:A.B.C.D.E都是元素周期表中前20号元素,原子序数依次增大,D的单质为淡黄色固体,则D为S;A、D同主族,则A为O;B、C、D同周期,即都在第三周期,B、C、D的最高价氧化物的水化物两两混合均能发生反应,则B为Na,C为Al;E与其它元素既不在同周期也不在同主族,则为第四周期第ⅡA族,则E为Ca,
(1)非金属性O>S,则A和D的氢化物中稳定性较弱的D,A和B的离子具有相同的电子排布,原子序数大的离子半径小,则Na+的离子半径小,故答案为:D;Na+;
(2)C为Al,在元素周期表中第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(3)E为Ca,其名称为钙,故答案为:钙;
(4)C、D的最高价氧化物的水化物分别为Al(OH)3、H2SO4,离子反应为Al(OH)3+3H+═Al3++3H2O,故答案为:Al(OH)3+3H+═Al3++3H2O.
本题解析:
本题难度:一般
3、选择题 已知短周期元素的离子aA2+、bB+、cC3–、dD–都具有相同的电子层结构,则下列叙述正确的是
A.原子半径:r(A)>r(B)>r(D)>r(C)
B.原子序数:b>a>c>d
C.离子半径:r(C3–)>r(D–)>r(B+)>r(A2+)
D.单质的还原性:A>B>D>C
参考答案:C
本题解析:试题分析:aA2+、bB+、cC3–、dD–都具有相同的电子层结构,则一定满足关系式a-2=b-1=c+3=d+1。其中A和B属于金属,位于同一周期,且A在B的右侧。C和D是非金属,位于同一周期,且位于A和B的上一周期,其中D位于C的右侧。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以只有选项C是正确的,答案选C。
考点:考查元素周期表的结构和元素周期律的应用
点评:该题是中等难度的试题,试题综合性强,贴近高考。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
4、推断题 已知X,Y,Z都是短周期的元素,它们的原子序数依次递增。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层 的3倍,Y和Z可以形成2种以上气态化合物,则:
(1)X是______,Y是______,Z是______。
(2)由Y和Z组成,且Y和Z的质量比为7:20的化合物的化学式(分子式)是______。
(3)由X,Y,Z中的2种元素组成,且与X2Z分子具有相同电子数的2种离子是______和______。
(4)X,Y,Z可以形成1种盐,此盐中X,Y,Z元素的原子的个数比为4:2:3,该盐的化学式(分子式)是
_______。
参考答案:
(l)氢;氮;氧
(2)N2O5
(3)NH4+;OH-
(4)NH4NO3
本题解析:
本题难度:一般
5、选择题 W、X、Y、Z均为短周期主族元素。X为地壳中含量最多的元素;W的原子最外层电子数与核外电子总数之比为7:17;含Z元素的物质焰色反应为黄色;Y的原子序数是W和Z的原子序数之和的一半。下列判断正确的是
A.Y的氧化物既可溶于W氢化物的水溶液,又可溶于Z的氢氧化物水溶液
B.氢化物的沸点:X
D.电解ZW水溶液一段时间后,溶液pH增大
参考答案:D
本题解析:注意无机推断题的入手点,X是含量最多的元素,要记牢地壳中元素的含量顺序为O、Si、Al、Fe等,所以X为O;根据最外层电子数不超过8,可知W电子总数为17,W是Cl元素;焰色反应为黄色的Z是Na元素;由Y的原子序数是W和Z的原子序数之和的一半,从而又可得到Y为Si。
A项SiO2能和NaOH反应,而不能与HCl反应,所以A错;B中水常温下为液态,而HCl为气态,所以氢化物的沸点应该为:X﹥W,B错误;C中注意Na与O可以生成含共价键和离子键的Na2O2或者是只含离子键的Na2O,所以C错误;D是电解食盐水,产物为H2、O2、NaOH,所以溶液的pH会增大,D项正确。
考点:考查元素推断,并考查二氧化硅的性质、氢化物的熔沸点、钠的氧化物、电解食盐水等相关知识
点评:原子结构理论、基础知识的综合运用,属于简单题型
本题难度:困难